«Здоровье» (АКИpress) — Саркопения, связанное с возрастом снижение мышечной функции, ложится значительным бременем на системы здравоохранения. В то время как стереотипные признаки саркопении хорошо охарактеризованы, их вклад в атрофию мышц остается неуловимым, что отчасти связано с ограниченной доступностью моделей на животных.
Мы выполнили клеточную и молекулярную характеристику скелетных мышц африканского киллифиша — чрезвычайно короткоживущего позвоночного — и показали, что, хотя многие характеристики ухудшаются с возрастом, поддерживая использование киллифиша в качестве модели для исследования саркопении, некоторые особенности удивительно обратны. К «раннему» состоянию на очень старых стадиях. Это говорит о том, что у очень старых животных могут существовать механизмы, предотвращающие дальнейшее ухудшение состояния скелетных мышц, способствуя увеличению продолжительности жизни. В соответствии с этим мы сообщаем о снижении уровня смертности очень старых киллифишей.
Чтобы определить механизмы этого явления, мы использовали подход системной метаболомики, который показал, что во время старения происходит поразительное истощение триглицеридов, имитирующее состояние ограничения калорий. Это приводит к активации митогормезиса, повышению уровня Sirt1, что улучшает метаболизм липидов и поддерживает гомеостаз питательных веществ у очень старых животных. Фармакологическая индукция Sirt1 у старых животных была достаточной, чтобы индуцировать метаболический профиль, подобный позднему возрасту, подтверждая его роль в увеличении продолжительности жизни в популяциях позвоночных, которые являются долгоживущими от природы. В совокупности наши результаты показывают, что киллифиш — это не только новая модель для изучения биологических процессов, управляющих саркопенией,
Введение
Старение является естественным и универсальным явлением, которое оказывает разрушительное воздействие на все клетки и организмы и приводит к прогрессирующему снижению способности органов выполнять свои физиологические функции. Одним из таких органов являются скелетные мышцы, которые не только необходимы для передвижения, но также служат важным метаболическим и запасающим органом. Старение скелетных мышц, известное как саркопения, представляет собой сложный и многофакторный синдром, клинически определяемый возрастным снижением мышечной массы и силы.
На клеточном уровне саркопения характеризуется, среди прочего, атрофией мышечных волокон, нарушением протеолиза, дисфункцией стволовых клеток, ремоделированием и денервацией нервно-мышечных соединений, митохондриальной дисфункцией, окислительным стрессом и метаболическим перепрограммированием (рассмотрено в Hardee & Lynch, 2019). Хотя стереотипные признаки саркопении очень хорошо охарактеризованы, в настоящее время неясно, как они способствуют атрофии мышц. Поскольку человеческая популяция постоянно преодолевает барьеры ожидаемой продолжительности жизни, ожидается резкое увеличение распространенности и тяжести саркопении. Таким образом, существует острая необходимость в понимании механизмов, вызывающих саркопению, после чего могут быть определены и реализованы подходящие медицинские вмешательства, способствующие здоровому старению мышц.
Для изучения механистической основы саркопении ранее использовались несколько животных моделей, включая Caenorhabditis elegans, дрозофилу, рыбок данио и грызунов, таких как крысы, мыши и морские свинки. Совсем недавно новая животная модель — африканский бирюзовый киллифиш, Nothobranchius furzeri (далее именуемый киллифиш) — привлекла большое внимание в области изучения старения. В результате эфемерного характера окружающей среды киллифиши эволюционировали, чтобы показать самую короткую известную продолжительность жизни среди всех видов позвоночных, которых можно разводить в неволе. Важно отметить, что их короткая продолжительность жизни сопровождается каноническими фенотипами старения, включая появление новообразований в печени и половых железах (Cicco et al., 2011), снижение регенеративной способности плавника (Wendler et al., 2015), снижение числа копий и функции митохондриальной ДНК (Hartmann et al., 2011) и укорочение теломер (Hartmann et al., 2009) (обзор в Hu & Брюнет, 2018). Несмотря на то, что киллифиши демонстрируют многие признаки старения, в настоящее время неизвестно, проявляют ли они саркопенические патологии, и поэтому их пригодность в качестве модели для исследования саркопении остается под вопросом.
Поэтому в этом исследовании мы провели тщательную клеточную и молекулярную характеристику скелетных мышц на ранних стадиях жизни, в возрасте и очень старых стадиях поздней жизни. Мы обнаружили, что многие из исследованных характеристик, включая количество мышечных стволовых клеток и мышечную иннервацию, ухудшаются с возрастом, что согласуется с проявлениями саркопении. В противоположность этому, мы выявили вторую подгруппу характеристик, состоящую из размера мышечных волокон и протеолиза, которые ухудшились у старых рыб, но улучшились у очень старых рыб позднего возраста. Выявление признаков, которые меняются на поздних стадиях жизни, предполагает, что у очень старых животных могут существовать механизмы, предотвращающие дальнейшее ухудшение здоровья скелетных мышц, что в конечном итоге может способствовать увеличению продолжительности их жизни. В соответствии с этой гипотезой, используя беспристрастный математический подход, мы выявили, что стадия позднего возраста, на которой мы наблюдали улучшение мышечного здоровья, полностью совпадает со стадией, когда уровень смертности снижается. Поэтому мы постулируем, что улучшение здоровья мышц может быть критическим фактором, способствующим увеличению продолжительности жизни у очень старых людей.
Чтобы определить потенциальные механизмы увеличения продолжительности жизни у очень старых животных позднего возраста, мы изучили метаболизм, который, как ранее было показано, является сильным фактором долголетия. Используя подход системной метаболомики, мы выявили, что при старении происходит поразительное истощение триглицеридов, одного из важнейших энергетических резервов в организме. Подобно механизмам, о которых сообщалось для увеличения продолжительности жизни при режимах ограничения калорий, мы наблюдали активацию митогормезиса, механизма устойчивости к стрессу, опосредованного активными формами кислорода, у очень старых животных. Мы предполагаем, что это приводит к улучшению метаболизма липидов и поддержанию гомеостаза питательных веществ в очень старой когорте, что обеспечивает механизм увеличения их продолжительности жизни.
РЕЗУЛЬТАТ
У старых киллифишей наблюдается атрофия мышечных волокон
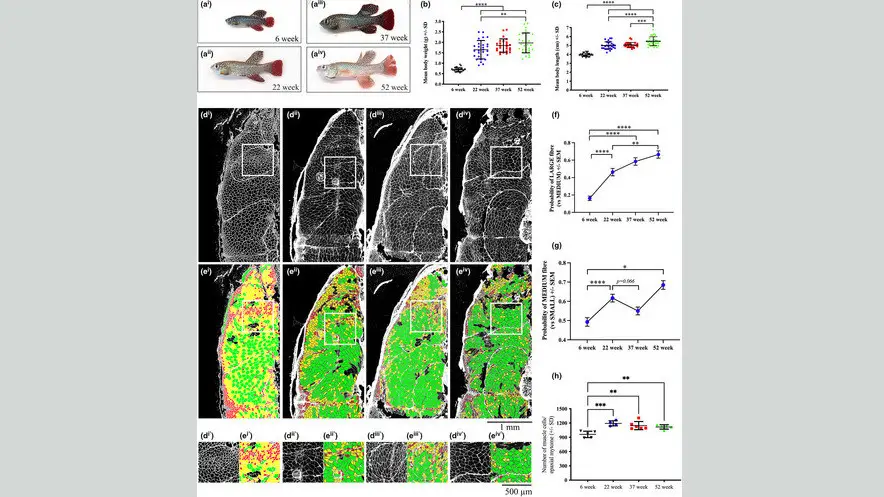
У многих видов рыб рост происходит на протяжении всей жизни животного (обзор в Ruparelia et al., 2019). Чтобы охарактеризовать закономерности роста киллифиша, мы исследовали размер тела в четыре временные точки на протяжении всей жизни рыбы: две стадии ранней жизни в 6 недель и 22 недели, при которых выживаемость составляет 100% и 92,3% соответственно; возрастной момент в 37 недель с выживанием 73,4% и чрезвычайно старый, поздний период жизни в 52 недели, при котором живыми являются только 17,9% рыб (Wendler et al., 2015).
С 6-недельного до 22-недельного возраста масса тела и длина тела увеличились в 2,4 и 1,2 раза соответственно, что отражает фазу взрывного роста (рис. 1a–c). После этой стадии, в то время как масса тела и длина оставались неизменными в 37-недельном возрасте, мы наблюдали значительное увеличение обоих параметров у 52-недельной рыбы (рис. 1a–c). Это свидетельствует о том, что в отличие от старых животных, молодые и очень старые поздние киллифиши сохраняют способность к постоянному росту.
Рис. 1
У старых киллифишей наблюдается атрофия скелетных мышц, которая у рыб позднего возраста стабилизируется. (a i – a iv) Репрезентативное изображение 6-недельного раннего возраста, 22-недельного раннего возраста, 37-недельного возраста и 52-недельного позднего возраста самца киллифа. Количественная оценка массы тела (b) и длины тела (c) рыбы в каждый из четырех моментов времени. Столбики погрешностей представляют ± SD. (d i – d iv ) Репрезентативные изображения маркировки коллагена у самцов киллифи в возрасте 6, 22, 37 и 52 недель. (d i′ –d iv′ )
(e) Тепловая карта распределения волокон по размерам, где мелкие волокна показаны красным, средние – желтым, а крупные – зеленым. (e i′ –e iv′) (f) Вероятность крупных (> 2600 мкм 2) волокон по сравнению со средними (между 1000 и 2600 мкм 2 ) волокнами. Столбики погрешностей представляют ± SEM. (g) Вероятность средних (между 1000 и 2600 мкм 2) волокон по сравнению с малыми (<1000 мкм 2) волокнами. Столбики погрешностей представляют SEM.
(h) Количество мышечных волокон на каждом из четырех этапов. Столбики погрешностей представляют ± SD. * р < 0,05; ** р < 0,01; *** р < 0,001; и **** p < 0,0001, рассчитанное с использованием однофакторного дисперсионного анализа с апостериорным тестом множественной коррекции Тьюки или обобщенного смешанного моделирования Лиара с апостериорным тестом множественной коррекции Бонферрони.
Чтобы точно определить, как возраст влияет на размер и количество мышечных волокон, мы окрашивали мышечные поперечные срезы антиколлагеновыми антителами, которые метят внеклеточный матрикс, окружающий отдельные мышечные волокна, а затем использовали полуавтоматический метод для измерения поперечных срезов. площади сечения отдельных мышечных волокон и определяют их суммарное количество. Мышечные волокна были классифицированы как мелкие (красные), средние (желтые) и крупные (зеленые), а их пространственное распределение было изучено с использованием нового вычислительного подхода, основанного на представлении тепловой карты (рис. 1d-e). В то время как мелкие мышечные волокна были обнаружены преимущественно поверхностно, в соответствии с тем, что эти области были зонами роста, средние и крупные волокна составляли более глубокие части миотома, хотя в этих областях также было видно небольшое количество мелких волокон. В соответствии с поразительным увеличением размеров тела вероятность крупных мышечных волокон (по сравнению со средними мышечными волокнами) значительно увеличивалась с возрастом (рис. 1f ). Однако, в то время как вероятность мышечных волокон среднего размера (по сравнению с мелкими мышечными волокнами) значительно увеличилась с 6-й до 22-й недели, мы наблюдали неожиданное снижение с 22-й до 37-й недели, которое приближалось к значимости (p = 0,066), но не в 52 недели (рис. 1g). Примечательно, что хотя количество мышечных клеток значительно увеличилось с 6-недельного возраста до 22-недельного, что отражает фазу взрывного роста, количество мышечных волокон оставалось неизменным после 22-недельного возраста, что указывает на то, что у старых киллифиш не наблюдается гипоплазии (рис. 1h). В совокупности эти данные показывают, что у старых рыб-киллифи наблюдается атрофия, особенно волокон среднего размера, и что у очень старых рыб позднего возраста мышцы не только защищены от атрофии, но и продолжают подвергаться гипертрофическому росту.
Повышенная регуляция атрогина-1 очевидна у старых киллифов.
Молекулярным признаком атрофии скелетных мышц является активация атрогенов: атрогина1 (MAFbx, FBXO32) и murf1 (TRIM63) (обзор в (Bodine & Baehr, 2014 )). Атрогены кодируют E3-убиквитинлигазы, которые нацелены на другие белки для деградации через убиквитин-протеазную систему, что впоследствии приводит к ускоренной деградации белков и атрофии мышц. Учитывая, что мы наблюдали атрофию мышц у старых киллифишей, мы предположили, что экспрессия атрогена будет усиливаться во время этой фазы. Чтобы проверить эту гипотезу, мы исследовали экспрессию атрогина1 и murf1 в образцах мышц киллифа в четырех временных точках. Наши анализы показывают, что уровни атрогина-1 достигают пика в группе 37-недельного возраста (рис. 2а), и это коррелирует с моментом времени, когда впервые проявляется мышечная атрофия. Однако в 52 недели уровни атрогина-1 значительно ниже, чем в 37 недель, и сравнимы с 22-недельными рыбами, что потенциально объясняет, почему размер мышечных волокон на очень старой стадии позднего периода жизни сохраняется. Напротив, экспрессия murf1 увеличивается на 22-й неделе без очевидных дальнейших изменений в экспрессии (рис. 2а ).
Когорты пожилых людей и лиц позднего возраста демонстрируют различные клеточные и физиологические характеристики. (а) анализ qRT-PCR атрогина1 и murf1 экспрессия в 6-недельном раннем возрасте, 22-недельном раннем возрасте, 37-недельном возрасте и 52-недельном позднем возрасте самцов киллифиша. Уровни относятся к 6-недельной рыбе, а планки погрешностей представляют собой ± стандартная ошибка среднего.
(b) Вестерн-блот-изображения для LC3 и p62, а также окрашивание общего белка прямым синим на белковых лизатах 6-недельных, 22-недельных, 37-недельных и 52-недельных самцов киллифиша. Чтобы точно отразить изменения, наблюдаемые в уровнях LC3 и p62, отображаются три представленных образца с каждой стадии. Количественное определение отношения LC3II/LC3I (c) и уровней p62, нормализованных к общему белку (d). Столбики погрешностей представляют собой ± стандартное отклонение. (e–h) Репрезентативные изображения Pax7, конъюгированного агглютинина зародышей пшеницы (WGA) и маркировки Dapi на мышцах 6-недельных, 22-недельных, 37-недельных и 52-недельных самцов киллифишей. Также включена тепловая карта, отображающая распределение волокон по размерам.
(i) Общее количество мышечных стволовых клеток Pax7+/Dapi+/на волокно в каждый момент времени. Столбики погрешностей представляют ± SD. (j) Количество мышечных стволовых клеток Pax7+/Dapi+/на небольшое волокно в каждый момент времени. Столбики погрешностей представляют ± SD. (k) Количество мышечных стволовых клеток Pax7+/Dapi+/на волокно среды в каждый момент времени. Столбики погрешностей представляют ± SD.
(l) Количество мышечных стволовых клеток Pax7+/Dapi+/на большое волокно в каждый момент времени. Столбики погрешностей представляют ± SD. (мi – m iv ) Репрезентативные изображения концевых пластинок в максимальной проекции, помеченных гликопротеином синаптических пузырьков 2A (зеленый) для обнаружения пресинаптических концов и α-бунгаротоксином (красный) для визуализации ацетилхолиновых рецепторов на постсинаптических концах, через 6 недель, 22 недели , 37-неделя и 52-неделя мышцы. Стрелки указывают примеры денервированных концевых пластинок, которые положительны на α-бунгаротоксин (красный), но не на гликопротеин 2А синаптических пузырьков (зеленый).
На вставке показано увеличенное изображение преобладающих концевых пластинок, представленных в каждый момент времени: 6-недельная, 22-недельная и 37-недельная, демонстрирующая иннервированные замыкательные пластинки, и 52-недельные образцы, демонстрирующие денервированные замыкательные пластинки. Масштабная линейка для вставки заключена в рамку. ( н) Процент денервированных концевых пластинок у 6-недельных, 22-недельных, 37-недельных и 52-недельных самцов киллифиша. Столбики погрешностей представляют ± SD. (o) анализ qRT-PCR ацетилхолиновых рецепторов -α (chrna1), -β (chrnb1), -γ (chrng) и -δ(chrnd) на 6-й, 22-й, 37-й и 52-й неделях. недельный самец киллифиша. (p) qRT-PCR анализ миогенина (myog), миогенного фактора 5 (myf5) и белка дифференцировки миобластов 1 (myoD) у 6-недельных, 22-недельных, 37-недельных и 52-недельных самцов киллифиша. Уровни относятся к 6-недельной рыбе, а планки погрешностей представляют собой ± стандартная ошибка среднего. * р < 0,05; ** р < 0,01; *** р < 0,001; и **** p <0,0001, рассчитанное с использованием одно-/двухфакторного дисперсионного анализа с апостериорным тестом множественной коррекции Тьюки или критерием хи-квадрат.
Альтернативный путь очистки белков и поврежденных органелл — аутофагия. Было показано, что как чрезмерная, так и дефектная аутофагия приводят к атрофии мышечных волокон. Чтобы определить, как аутофагия влияет на мышцы киллифиша, мы исследовали уровни LC3 и p62, двух маркеров аутофагосом. Хотя уровни белка сильно различались, как показано в трех образцах из каждой временной точки (рис. 2b), наблюдалось значительное снижение уровней p62 (рис. 2b, c) и увеличение соотношения LC3II/LC3I (рис. 2b, d).) наблюдали у 52-недельных рыб. Эти результаты показывают, что, хотя аутофагия не изменяется при старении, она увеличивается у очень старых киллифи позднего возраста. Учитывая, что повышенная аутофагия из-за ограничения калорий, физических упражнений, снижения митохондриального дыхания и фармакологических вмешательств, помимо прочего, способствует увеличению продолжительности жизни (Hansen et al., 2018), мы предположили, что у очень старых рыб позднего возраста , более высокие показатели аутофагии могут играть полезную роль.
Отличительные черты мышечного старения проявляются в пожилом возрасте, но не стареют.
Чтобы дополнительно охарактеризовать биологию мышц в пожилом и позднем возрасте, мы изучили две характеристики, которые, как известно, ухудшаются с возрастом в мышцах млекопитающих. Мы предсказали, что обе эти характеристики будут ухудшаться в возрастной когорте. Первая изученная нами характеристика — это количество мышечных стволовых клеток Pax7+, которые не только истощаются с возрастом, но и демонстрируют нарушение функции, что впоследствии препятствует регенеративной способности мышц (Chakkalakal et al., 2012; Kimmel et al., 2020). С этой целью мы окрашивали поперечные срезы мышц, полученные из мышц туловища перед анальным плавником, антителами к Рах7 для обнаружения мышечных стволовых клеток, Dapi для выявления ядер и конъюгированным агглютинином зародышей пшеницы (АЗП) для маркировки мышц. волокнистая мембрана. Впоследствии мы использовали наш инструмент тепловой карты для идентификации малых, средних и крупных волокон, после чего мы подсчитали количество мышечных стволовых клеток Pax7+, Dapi+, связанных с 20–30 мышечными клетками каждой из трех категорий размеров. Наш анализ показал, что, хотя не было значительных изменений в общем количестве мышечных стволовых клеток Pax7+ между 6-недельными, 22-недельными и 37-недельными киллифишами, значительное снижение в 52-недельной когорте по сравнению с 22-недельными наблюдалось (рис. 2e,f,g,h,i; расширенные данные, рис. 1 в данных S1). Затем мы проверили, было ли это снижение связано с определенным размером мышечного волокна. Наши результаты показывают, что как в малых, так и в крупных волокнах наблюдается снижение количества стволовых клеток, в то время как количество стволовых клеток, связанных со средними волокнами, не меняется с возрастом (рис. 2j,k,l ).
Дополнительным, хорошо охарактеризованным изменением, происходящим при старении скелетных мышц, является ухудшение состояния нервно-мышечных соединений и денервация стареющих мышц (Liu et al., 2017; Valdez et al., 2010), что впоследствии ставит под угрозу нейротрансмиссию, ухудшает мышечное сокращение и приводит к возрастной мышечной слабости. Чтобы определить, происходит ли денервация с возрастом в мышцах киллифии, мы получили продольные срезы туловищной мышцы перед анальным плавником и окрасили концевые пластинки мышц антителами к гликопротеину синаптических везикул 2A (SV2) для идентификации пресинаптических везикул и α-бунгаротоксином для идентификации пресинаптических везикул, обозначают постсинаптические окончания. Впоследствии мы количественно определили денервированные замыкательные пластинки, идентифицированные по потере пресинаптического окрашивания SV2, но по наличию постсинаптического окрашивания α-бунгаротоксином. В отличие от нашей гипотезы, денервация мышц не затрагивалась в когорте 37-недельного возраста, но вместо этого мы обнаружили значительное увеличение процента денервированных концевых пластинок на 52-недельной поздней стадии жизни (рис. 2м,н). Чтобы на молекулярном уровне подтвердить это открытие, мы исследовали экспрессию генов никотиновых ацетилхолиновых рецепторов и генов, связанных с миогенезом, которые характерно увеличиваются при денервации (Wu et al., 2014). Действительно, было обнаружено, что 52-недельные рыбы позднего возраста демонстрируют повышенную экспрессию никотинового ацетилхолинового рецептора γ (chrng), хотя экспрессия подтипов α (chrna1), β (chrnb1) и δ (chrnd) осталась неизменной (рис. 2o ). У 52-недельной рыбы позднего возраста также наблюдалась повышенная экспрессия миогенина, миогенного фактора 5 (myf5) и белка 1 дифференцировки миобластов (myoD) по сравнению с 37-недельной рыбой (рис. 2p), что в совокупности подтверждает, что денервация мышц происходит у очень старых рыб, но не в фазах старения. В соответствии с поразительной денервацией, наблюдаемой в этом исследовании, предыдущие анализы с использованием более короткоживущего штамма GRZ показали, что у старых киллифиш наблюдается значительное снижение двигательной активности (Valenzano et al., 2006).
Хотя возможности передвижения очень старых животных в нашем исследовании не изучались, мы можем подтвердить, что животные ведут очень малоподвижный образ жизни по сравнению с более молодыми животными. Примечательно, что увеличение количества миогенных генов на поздних стадиях жизни также может свидетельствовать об увеличении слияния мышечных стволовых клеток с существующими мышечными клетками, что может объяснить наблюдаемое снижение количества мышечных стволовых клеток и последующее сохранение размера мышечных волокон. Интересно, что мышечные стволовые клетки, как было показано, способствуют регенерации нервно-мышечных соединений после денервации (Liu et al., 2017), а снижение количества стволовых клеток у очень старых животных также может быть причиной дегенерации нервно-мышечных соединений во время денервации.
Взятые вместе эти результаты подчеркивают три ключевых момента: во-первых, старые и очень старые киллифиши демонстрируют многие признаки саркопении, что поддерживает их использование в качестве модели для исследования саркопении. Во-вторых, старые и очень старые киллифиши демонстрируют разные фенотипы, что позволяет предположить, что эти две фазы физиологически различны. Наконец, у очень старых животных наблюдалась комбинация изменений, когда одни характеристики ухудшались (количество стволовых клеток и мышечная иннервация), а другие улучшались (размер волокон и протеолиз). Эти результаты неожиданно показывают, что не все аспекты здоровья мышц ухудшаются у очень старых животных и что могут запускаться определенные пути для защиты мышц от дальнейшего ухудшения.
Крайне старая временная точка совпадает со стадией снижения смертности.
Выявление характеристик, которые улучшаются у очень старых киллифишей, предполагает, что могут существовать механизмы, предотвращающие дальнейшее ухудшение здоровья скелетных мышц, что, по нашим прогнозам, может способствовать увеличению продолжительности их жизни. Чтобы определить, сопровождается ли чрезвычайно старая стадия снижением смертности на популяционном уровне, мы повторно изучили данные о выживаемости из наших ранее опубликованных анализов продолжительности жизни (Wendler et al., 2015) .). Мы рассчитали кумулятивную смертность на протяжении всей жизни рыбы и нанесли данные на логарифмическую шкалу с основанием 10. Используя эту стратегию, мы обнаружили, что, хотя изначально уровень смертности низкий, экспоненциальный рост смертности очевиден на более поздних стадиях. Важно отметить, что за этим следует плато кумулятивных показателей смертности, что подтверждает нашу гипотезу о том, что показатели смертности снижаются на очень старых стадиях. (Рисунок 3а).
Чтобы математически определить точный возраст, в котором показатели смертности снижаются, мы использовали метод оценки поверхности экстремума (ESE) для поиска точек перегиба, характеризующихся изменениями траекторий данных с течением времени, в наборе данных о смертности. Вкратце, ESE работает за счет максимизации/минимизации функции, отображающей данные о смертности во времени, которая соответствующим образом и беспристрастно определяет точки перегиба (Christopoulos, 2012, 2016). Наш анализ выявил две точки перегиба — одну на 38-й неделе и вторую на 48,5-й неделе, демонстрируя, что киллифиш имеют три различных этапа жизненного цикла: период до 38-недельного возраста, отражающий фазу «ранней жизни», 38-недельный период до 48,5 недель представляет собой «стареющую» когорту, в которой показатели смертности демонстрируют экспоненциальную тенденцию Гомперца, а рыбы после 48,5 недель находятся на стадии «поздней жизни» своей продолжительности жизни, при которой уровень смертности выходит на плато (рис. 3b). Важно отметить, что уровень смертности стабилизируется на той же стадии, на которой мы наблюдали улучшение здоровья мышц, что подтверждает нашу гипотезу о том, что выявленные нами характеристики могут иметь решающее значение для регулирования увеличения продолжительности жизни у очень старых людей.
Рис. 3
Крайне старая временная точка совпадает со стадией снижения смертности. ( а ) Совокупная смертность самцов киллифиша MZM-0703, представленная в логарифмической шкале (n = 39). (b) Диаграмма рассеяния точек перегиба данных о смертности в логарифмическом масштабе, определенная с использованием метода оценки экстремальной поверхности. Гладкая линия основана на локальном регрессионном анализе, а серая зона вокруг гладкой кривой показывает границы стандартной ошибки, рассчитанные с использованием t-аппроксимации. Две точки перегиба, выявленные на 38-й и 48,5-й неделях, показаны пунктирной линией.
Очень старые животные демонстрируют метаболический профиль, который больше похож на возрастные когорты.
Учитывая, что метаболизм является сильным фактором долголетия и что скелетные мышцы являются высокоактивным метаболическим органом, мы предположили, что метаболические изменения могут объяснить различия в клеточной биологии и продолжительности жизни, наблюдаемые между старыми и очень старыми животными. С этой целью мы использовали нецелевой метаболомный подход, исследуя образцы мышц 22-недельной ранней жизни, 37-недельного возраста и 52-недельной очень старой рыбы позднего возраста. Вкратце, образцы быстрозамороженных мышц из сопоставимых передне-задних положений были подвергнуты криопульверизации, метаболиты были извлечены и подвергнуты жидкостной хроматографии в сочетании с масс-спектрометрией высокого разрешения (ЖХ-МС) (рис. 4а). Используя этот подход, мы предположительно идентифицировали 1160 метаболитов в 20 образцах. Анализ основных компонентов (PCA) всех метаболитов выявил четкую кластеризацию трех временных точек, усиливая отчетливость различных жизненных фаз (рис. 4b). Интересно, что график оценок PCA показал, что 22-недельные выборки попали между 37-недельными и 52-недельными выборками по первому основному компоненту, а неконтролируемый иерархический кластерный анализ показал, что 22-недельные ранние и 52-недельные поздние наборы данных о жизни более тесно связаны друг с другом, чем 37-недельная рыба (рис. 4c). Это говорит о том, что некоторые аспекты метаболизма в очень старом возрасте напоминают состояние раннего периода жизни. С другой стороны, во втором основном компоненте 37-недельная и 52-недельная очень старая рыба больше похожи друг на друга, подчеркивая различный набор метаболитов, которые не реверсируются на позднем этапе жизни, как те в первой главной компоненте. В целом, наш глобальный анализ метаболизма мышц предполагает, что некоторые метаболические процессы меняются на противоположные, что совпадает с началом чрезвычайно старой фазы.
Рис. 4
Рыбы позднего возраста демонстрируют метаболический профиль, который больше похож на когорты ранних возрастов. (а) Схема экспериментального дизайна: мышцы из сопоставимых передне-задних положений были извлечены и быстро заморожены. Готовые к экстракции быстрозамороженные мышцы подвергали криопульверизации, метаболиты экстрагировали, после чего проводили жидкостную хроматографию в сочетании с масс-спектрометрией высокого разрешения (ЖХ-МС). (b) Главный компонент анализирует график оценки всех метаболитов в скелетных мышцах самцов киллифи в возрасте 22 недель (синий), в возрасте 37 недель (красный) и в возрасте 52 недель (зеленый). Очевидна группировка образцов по возрасту.
(c) Дендрограмма неконтролируемого иерархического кластерного анализа с использованием Спирмена. Ранговая корреляция s показывает, что наборы данных о 22-недельной ранней жизни и 52-недельной поздней жизни более тесно связаны друг с другом, чем данные о 37-недельной рыбе. ( d ) Схема пяти широких типов тенденций метаболитов, где 22-недельные образцы показаны синим цветом, 37-недельная когорта — красным, а 52-недельная рыба — зеленым. Пунктирные линии представляют незначительные изменения сp > 0,05, а сплошные линии отражают значимые изменения при p < 0,05. (e) График распространенности каждого из пяти типов тренда. (f) Сеть всех метаболитов, идентифицированных в нашем наборе данных, определенная с помощью анализа совместного содержания. Метаболиты с тенденцией инверсии в форме колокола (красный) обогащены в центре сети. (g) Круговая диаграмма, изображающая метаболические пути, к которым относятся 15 наиболее влиятельных метаболитов в сети, причем наиболее представлен метаболизм липидов. (h) Круговая диаграмма, изображающая обогащение различных метаболических путей в группе колоколообразных инверсий, при этом на белковый и липидный метаболизм приходится более половины всех метаболитов в этой группе. (i) График распространенности видов пептидов в пяти группах.
Затем мы применили подход системной биологии, чтобы беспристрастно проанализировать специфические изменения, происходящие на трех разных стадиях. Для этой цели мы использовали дисперсионный анализ (ANOVA) и корреляционный анализ Пирсона, чтобы определить группы метаболитов, которые демонстрировали аналогичные или значительные изменения в количестве метаболитов в трех временных точках. Используя эту стратегию, каждый метаболит классифицируется как однозначно принадлежащий к одной из 17 тенденций (расширенные данные, рис. 2 в данных S1), которые в целом подразделяются на пять групп (рис. 4d): метаболиты в группе 1 демонстрируют монотонное поведение в том, что их количество существенно не меняется на протяжении всей жизни рыбы (рис. 4г). Метаболиты, которые значительно изменяются с возрастом, могут быть помещены в одну из четырех групп, соответствующих: повышенная регуляция с возрастом, пониженная регуляция с возрастом, колоколообразная инверсия, при которой их содержание в 37-недельном возрасте выше, чем в 22-недельном возрасте и 52 очень старые недельные когорты или U-образная инверсия, в которой их численность на 37-й неделе ниже, чем на 22-й и 52-й неделе (рис. 4d) . Неудивительно, что для большинства метаболитов (72,1%) не наблюдается существенных изменений с возрастом (рис. 4д ). Однако из метаболитов, которые значительно изменяются с возрастом, группа колоколообразных инверсий оказалась преобладающей группой, на которую приходится 12,8% всех метаболитов (рис. 4e). Обогащение метаболитов в группе колоколообразных инверсий, характеризующееся повышенным содержанием в возрастной группе и неразличимыми уровнями между молодыми и очень старыми мышцами, подтверждает наш аргумент о том, что в более позднем возрасте определенные аспекты метаболизма возвращаются к уровням активности, которые больше напоминают молодость.
Чтобы определить конкретные метаболиты, которые могут играть центральную роль в различении и/или управлении старением и очень старыми стадиями, мы оценили корреляцию уровней метаболитов в трех временных точках выборки, после чего была построена ассоциативная сеть (рис. 4f). Примечательно, что мы обнаружили, что метаболиты, расположенные наиболее центрально в сети и наиболее взаимосвязанные с другими метаболитами, преимущественно принадлежат к группе колоколообразных инверсий, что подтверждает тот факт, что колоколообразные метаболиты могут быть ключевыми игроками, регулирующими метаболизм у пожилых и чрезвычайно старые животные. Чтобы определить наиболее влиятельные метаболиты в сети, мы использовали наш новый алгоритм «Integrated Value of Significance» (IVI) (Salavaty et al., 2020), который сочетает в себе различные меры центральности для охвата всех топологических измерений сети, а затем ранжирует каждый метаболит на основе авторитетного положения, которое он занимает в сети (подробную методологию см. В разделе «Методы»). Метаболиты с самым высоким IVI представляют собой те, которые имеют самое высокое местное и глобальное влияние во всей сети, и на основе этого подхода 15 наиболее влиятельных метаболитов задокументированы в расширенной таблице данных 1 в данных S1. Из этих 15 метаболитов 12 имеют тенденцию к инверсии в форме колокола, что указывает на то, что накопление этих метаболитов во время старения и последующее их уменьшение в течение очень старых поздних стадий жизни может быть центральным в различении и физиологической регуляции двух фаз взрослой жизни. Примечательно, что 11 из этих 15 метаболитов соответствуют липидам (расширенная таблица данных 1 в данных S1; рисунок 4g ), что позволяет предположить, что метаболизм липидов может быть центральным путем, который регулирует весь метаболизм и способствует увеличению продолжительности жизни.
Метаболизм белков и липидов чрезмерно представлен в колоколообразной группе метаболитов.
Поскольку наши анализы показали, что колоколообразный кластер представляет собой самую большую группу значительно измененных метаболитов, и что это колоколообразное обилие соответствует ожидаемому профилю метаболитов, связанному со снижением смертности на поздних стадиях жизни, все дальнейшие анализы были сосредоточены на на этой группе. Используя подход, описанный в предыдущем разделе, мы распределили каждый из 149 метаболитов, демонстрирующих колоколообразные профили инверсии, по соответствующим путям, в которые они вовлечены. Наш анализ показал, что, за исключением 14 метаболитов, которые либо отсутствовали во всех базах данных, либо не имеет известных функций у животных, все остальные метаболиты можно отнести к одному из восьми основных путей (рис. 4h). Важно отметить, что белковые (29,5%) и липидные (28,2%) метаболиты были широко представлены в колоколообразной группе, что делает их основными путями-кандидатами для увеличения продолжительности жизни очень старой группы, и поэтому мы исследовали их в исследовании. дальнейшие детали.
Повышенный распад белка очевиден во время старения
Поскольку белковый метаболизм является одним из двух широко представленных путей, мы решили изучить его более подробно, уделив особое внимание коротким (от ди- до тетра-) пептидам, которые, как известно, преимущественно идентифицируются в нашем рабочем процессе метаболомики. Мы обнаружили, что, хотя 53 из 85 обнаруженных пептидов существенно не изменились с возрастом, более четверти продемонстрировали тенденцию к инверсии в форме колокола (рис. 4i). Пептиды обычно связаны с протеолизом и обменом белков (Lecker & Goldberg, 2002). Поскольку мы показали, что при старении увеличивается экспрессия убиквитинлигазы Е3 атрогина1 (рис. 2а), который, как известно, расщепляет белки и способствует атрофии, мы утверждаем, что выявленные нами метаболические изменения белка, скорее всего, являются отражением изменений в протеолизе и последующих изменениях размера мышечных волокон. То есть усиление атрогин-1-зависимого катаболизма белков во время старения приводит к увеличению содержания пептидов и атрофии мышечных волокон. Наоборот, сниженная экспрессия атрогина-1 на очень старых стадиях позднего периода жизни приводит к уменьшению протеолиза и образованию видов пептидов, впоследствии стабилизирующих размер мышечных волокон. Изменения в белковом обмене, которые мы наблюдали, вероятно, являются отражением изменений в белковом обмене и последующего изменения размера мышечных волокон.
Метаболизм липидов изменен у старых киллифи
Учитывая, что метаболизм липидов был другим путем, который был широко представлен в группе колоколообразных инверсий (рис. 4h ), и что он также был определен как наиболее влиятельный путь на основе нашего анализа IVI (рис. 4h и расширенная таблица данных 1 в Data S1), мы решили исследовать его дальше. Изучение всех метаболитов липидов в нашем наборе данных показало, что несколько подклассов липидов изменяются с возрастом (рис. 5а). Из них наиболее поразительными были триглицериды (TG) и диглицериды (DG), которые обогащены в пределах U-образной инверсии, фосфатидилинозитол (PI) фосфолипиды, которые широко представлены в группе с подавленной регуляцией, и церамиды, которые чрезмерно представлены в колоколообразной инверсионной группе (рис. 5а ).
Рис. 5
Истощение триглицеридов во время старения приводит к увеличению количества активных форм кислорода, что вызывает митогормезис у рыб позднего возраста.
(а) Распределение всех липидных метаболитов по пяти типам тренда: фосфатидилхолин (ФХ), фосфатидилэтаноламин (ФЭ), фосфатидилинозитол (ФИ), фосфатидилсерин (ФС), фосфатидилглицерин (ФГ), триглицериды (ТГ), диглицериды (ДГ) и свободные жирные кислоты (ЖК). В категорию «другие» входят ацилкарнитины, ацилглицины, кардиолипины, сфингомиелины и промежуточные продукты липидного обмена. Общая интенсивность триглицеридов (б), диглицеридов (в) и ЦДФ-холина (г). Столбики погрешностей представляют ± SD. (e) Уровень экспрессии генов кластера дифференцировки 36 (CD36) в каждый из трех моментов времени. Столбики погрешностей представляют ± SEM. (f) Уровень экспрессии генов карнитинпальмитоилтрансферазы 1b (cpt1b) и карнитинпальмитоилтрансферазы 2 (cpt2) в каждый из трех моментов времени. Столбики погрешностей представляют ± SEM. (g) Общая интенсивность всех короткоцепочечных видов ацилкарнитина. Столбики погрешностей представляют ± SD.
(h) Репрезентативные изображения вестерн-блоттинга для VDAC1 и окрашивания общего белка прямым синим на лизатах цельных клеточных белков 22-недельных, 37-недельных и 52-недельных самцов киллифиша. (i) Количественное определение уровней VDAC1, нормализованных к общему белку. Столбики погрешностей представляют ± SD. (j) Репрезентативные блоты BN-PAGE для белка комплекса I NADH: основной субъединицы S3 убихиноноксидоредуктазы (NDUFS3), белка комплекса II, субъединицы комплекса сукцинатдегидрогеназы B (SDHB), белка комплекса V, АТФ-синтазы, субъединицы F1 альфа (ATP5a) и митохондриального напряжения, зависимый анионселективный канал 1 (VDAC1) на митохондриальных лизатах, выделенных из 22-недельных, 37-недельных и 52-недельных самцов киллифиша. (k–m) Интенсивности NDUFS3, SDHB, и ATP5a нормализовали до VDAC1. Столбики погрешностей представляют ± SD. Общая интенсивность дисульфида глутатиона (n) и цистеинил-глутатион (o) у 22-недельных, 37-недельных и 52-недельных самцов киллифи. (pq) Уровни экспрессии генов антиоксидантных ферментов глутатионпероксидазы 1 (GPX1), цитозольной супероксиддисмутазы меди и цинка (SOD1, Cu и Zn-SOD) и марганцевой супероксиддисмутазы (SOD2, Mn-SOD). Столбики погрешностей представляют ± SEM. (r) Уровни экспрессии генов сиртуина 1 (sirt1) и коактиватора гамма-рецептора, активируемого пролифератором пероксисом 1 α (PGC1α). Столбики погрешностей представляют ± SEM. * р < 0,05; ** р < 0,01; *** р < 0,001; и **** p <0,0001 рассчитано с использованием однофакторного дисперсионного анализа с апостериорным тестом множественной коррекции Тьюки.
Чтобы лучше понять, как меняется метаболизм липидов во время старения и на очень старых этапах жизни, мы определили общее содержание каждого типа липидов, добавив пиковые интенсивности всех значительно измененных метаболитов в этом подтипе. Используя этот подход, наши анализы выявили значительные изменения в различных фосфолипидах, включая два наиболее распространенных вида фосфатидилхолина (PC) и фосфатидилэтаноламина (PE) (расширенные данные, рис. 3a,b в данных S1) ; и значительные изменения в менее распространенных фосфолипидах фосфатидилинозитоле (PI), фосфатидилсерине (PS) и фосфатидилглицерине (PG; расширенные данные, рис. 3c–e в данных S1). Накопление церамидов в когорте 37-недельного возраста также было очевидным (расширенные данные, рис. 3f в данных S1). Фосфолипиды и церамиды играют решающую роль в регуляции мышечного сокращения (Funai et al., 2013 , 2015), метаболизма (Lee et al., 2018 ; Newsom et al., 2016) и апоптоза (Turpin et al., 2006), а также таким образом, изменения их количества во время старения и в пожилом возрасте могут значительно повлиять на здоровье мышц на двух этапах, впоследствии способствуя снижению смертности.
Запасы триглицеридов истощаются у старых, но не очень старых рыб-киллифи.
Подкласс липидов, который наиболее сильно пострадал в нашем наборе данных, — это ТГ, который служит важным резервом энергии в скелетных мышцах (рис. 5а). Мы наблюдали типичную U-образную тенденцию в отношении уровней ТГ, поскольку они значительно снизились на 37-й неделе и накапливались на 52-й неделе (рис. 5а, б). Мы предположили, что снижение ТГ на 37-й неделе связано с повышенным распадом ТГ, а на 52-й неделе этот процесс тормозится, что приводит к накоплению ТГ. В поддержку этой гипотезы мы наблюдали значительное увеличение DG на 37-й неделе и обратное снижение на 52-й неделе (рис. 5c). Мы также наблюдали изменения в активности ЦДФ-холинового пути, который использует ДГ для синтеза большинства пулов ФХ. В соответствии с высокими уровнями липолиза, очевидными на 37-й неделе, мы наблюдали значительное увеличение уровня предшественника ФХ ЦДФ-холина (рис. 5d) и уровней ФХ (расширенные данные, рис. 3а в данных S1) на 37-й неделе, подчеркивая повышенный ФХ. синтез при старении. С другой стороны, на 52-й неделе уровни как ЦДФ-холина, так и ФХ были значительно снижены (рис. 5d; расширенные данные, рис. 3а в данных S1), что позволяет предположить, что синтез ФХ подавляется в пожилом возрасте, одновременно со снижением использование ДГ, что приводит к снижению липолиза и накоплению ТГ.
Альтернативным объяснением изменений запасов ТГ являются изменения в поглощении жирных кислот и/или утилизации ТГ посредством окисления жирных кислот и окислительного фосфорилирования (OXPHOS). Чтобы проверить гипотезу поглощения жирных кислот, мы исследовали экспрессию кластера дифференцировки 36 (CD36; также известного как транслоказа жирных кислот), интегрального мембранного белка, который транспортирует жирные кислоты в клетку. Наши анализы показали, что, хотя уровни CD36 не изменились в 37-недельном возрасте, значительное увеличение экспрессии CD36 было очевидно у 52-недельных рыб (рис. 5e). Этот результат показывает, что у старых киллифишей нет изменений в поглощении жирных кислот, что согласуется со сниженными запасами ТГ, но в очень старой фазе наблюдается повышенное поглощение жирных кислот, что также может способствовать увеличению количества ТГ.
Чтобы проверить гипотезу утилизации жирных кислот, мы сначала исследовали распределение типов волокон как сдвиг от гликолитических, быстрых мышечных волокон типа II, к окислительным, медленным фенотипу I типа (Larsson et al., 1978; Lee et al, 2006). Обычно наблюдается при саркопении и может привести к повышенному окислению жирных кислот и объяснить снижение запасов триглицеридов. Используя антитело к миозину, которое выявляет как медленную, так и быструю изоформу, и антитело, которое специфически выявляет медленную изоформу, мы обнаруживаем, что на всех стадиях медленная мышца, окрашенная обоими антителами к миозину, расположена поверхностно, с быстрыми мышечными волокнами, что окрашивается одним антителом к миозину, занимает остальную часть миотома (расширенные данные, рис. 4a–c в данных S1). Важно отметить, что мы не видели каких-либо медленных мышечных волокон глубже в миотоме, что свидетельствует об отсутствии переключения типа волокон (расширенные данные, рис. 4a–c в данных S1). Мы также изучили уровни белка миозина 7, который является изоформой медленных мышц, и легкой цепи миозина 2/3, которая обнаружена исключительно в быстрых мышцах (расширенные данные, рис. 4d в данных S1). Мы не наблюдали различий в содержании какой-либо из двух изоформ белка, подтверждая, что переключение типа волокон и сдвиг в сторону окисления жирных кислот не является признаком старения мышц у киллфишей (расширенные данные, рис. 4e в данных S1). Этот результат дополнительно подтверждается нашими данными метаболомики, которые показали, что метаболиты, участвующие в гликолизе и углеводном обмене, не изменяются в течение жизни рыбы (таблица расширенных данных 2 в данных S1). Таким образом, наши результаты предполагают, что снижение ТГ в 37 недель не связано с изменением предпочтения использования субстрата для производства энергии.
Чтобы дополнительно выяснить, ответственны ли изменения в окислении жирных кислот и окислительном фосфорилировании (OXPHOS) за резкие различия в количестве ТГ, мы исследовали экспрессию ферментов карнитинпальмитоилтрансферазы 1b (cpt1b) и карнитинпальмитоилтрансферазы 2 (cpt2), двух ферментов. Известно, что они переносят активированные жирные кислоты в форме ацилкарнитинов через внешнюю и внутреннюю митохондриальные мембраны соответственно. Наши результаты показывают, что уровни как cpt1b, так и cpt2 оставались неизменными в 37-недельных образцах (рис. 5f), предполагая, что транспорт активированных жирных кислот через митохондриальную мембрану не изменяется при старении. Однако на 52-й неделе мы наблюдали значительное увеличение экспрессии cpt1b (рис. 5f), демонстрируя, что в пожилом возрасте может происходить увеличение транслокации активированных жирных кислот в митохондрии. Мы также изучили, как виды ацилкарнитина влияют на продолжительность жизни рыб. Хотя в нашем наборе метаболомных данных была идентифицирована комбинация короткоцепочечных (C2–C6), средних (C7–C12) и длинноцепочечных (C13–C22) видов ацилкарнитина, было обнаружено, что только виды короткоцепочечного ацилкарнитина подвергаются значительному влиянию, как идентифицировано наш анализ ANOVA (рисунок 3g с расширенными данными в данных S1). Изучение общего содержания всех короткоцепочечных видов ацилкарнитина выявило значительное увеличение у 52-недельной рыбы, но не у 37-недельной группы, что еще раз подтверждает повышенное окисление жирных кислот в позднем возрасте, но не старение (рис. 5g). В качестве дополнительной проверки этого аргумента мы исследовали общее содержание митохондрий, используя вестерн-блоттинг для VDAC1 на лизате белка цельной клетки, и оценили количество различных митохондриальных комплексов OXPHOS в изолированных митохондриях, используя электрофорез в нативном синем геле (BNE). В то время как уровни VDAC1 у 37-недельной рыбы не изменились, мы наблюдали значительное снижение в 52-недельный момент времени (рис. 5h,i), что указывает на снижение содержания митохондрий на очень старом этапе поздней жизни. Кроме того, изучение количества комплексов OXPHOS выявило снижение содержания комплекса I в когортах 37-недельного возраста и 52-недельного возраста, умеренное увеличение содержания комплекса II в возрасте 52 недель, но отсутствие изменений в содержании комплекса V ( Рисунок 4j–m). Эти результаты свидетельствуют о том, что количество и функция митохондрий снижаются с возрастом, подтверждая аргумент о том, что окисление жирных кислот вряд ли может быть причиной более низких уровней проявляемых ТГ.
Таким образом, в совокупности наши результаты показывают, что в то время как во время старения происходит снижение пулов ТГ, вероятно, из-за повышенного липолиза, в очень старой когорте наблюдается снижение липолиза и увеличение поглощения жирных кислот и окисления жирных кислот, следствием чего является накопление ТГ.
Митогормезис, опосредованный активными формами кислорода, запускается в позднем возрасте.
Поразительное истощение триглицеридов, наблюдаемое у 37-недельной рыбы, напоминает ограничение калорий/диеты, поскольку оба они характеризуются снижением доступности питательных веществ. В частности, было показано, что ограничение калорий увеличивает продолжительность жизни у множества организмов за счет кратковременного увеличения количества активных форм кислорода (АФК) и последующего запуска защитной реакции на стресс, называемой митогормезисом, который изменяет транскрипционное состояние клетки, тем самым повышая стрессоустойчивость. и улучшение клеточного метаболизма (Agarwal et al., 2005; Cox et al., 2018; Mesquita et al., 2010; Owusu-Ansah et al., 2013; Schulz et al., 2007; Sharma et al., 2010; Weimer). и другие., 2014; Зарсе и др., 2012). Кроме того, было показано, что уменьшение количества комплексов OXPHOS после генетических и/или фармакологических манипуляций запускает митогормезис, опосредованный АФК, и увеличивает продолжительность жизни многих организмов, включая киллифиш (Baumgart et al., 2016; Copeland et al., 2009; Durieux et al. и др., 2011; Фэн и др., 2001; Ли и др., 2002). Учитывая, что у старых киллифиш наблюдается как истощение триглицеридов, напоминающее состояние ограничения калорий, так и резкое снижение комплексов OXPHOS, мы предположили, что АФК-опосредованный митогормезис может активироваться у рыб позднего возраста, что приводит к увеличению продолжительности их жизни и общему снижению показатели смертности. Чтобы проверить эту гипотезу, мы исследовали окислительно-восстановительный статус скелетных мышц в различные моменты времени. Сначала мы изучили уровни глутатиона, важного поглотителя АФК, в данных метаболомики. Хотя содержание глутатиона не изменилось (расширенные данные, рис. 3h в данных S1), мы наблюдали значительное увеличение его окисленной формы глутатиондисульфида (рис. 5n) и другого окисленного дисульфида, цистеинил-глутатиона (рис. 5o), на 37-й неделе, что указывает на повышенное содержание АФК. Учитывая высокую изменчивость, наблюдаемую для этих метаболитов глутатиона, вероятно, из-за склонности тиолов к легкому окислению в образцах, мы также исследовали уровни антиоксидантных ферментов глутатионпероксидазы 1 (GPX1), цитозольной медно-цинковой супероксиддисмутазы (SOD1, Cu-Zn-SOD) и супероксиддисмутазу марганца (SOD2, Mn-SOD). Наши анализы показывают поразительное снижение GPX1, SOD1 и SOD2 у 37-недельной рыбы (рис. 5p, q), и это может дополнительно увеличить АФК, что впоследствии активирует митогормезис.
Примечательно, что, несмотря на то, что антиоксидантные гены GPX1, SOD1 и SOD2 были значительно снижены у старых киллифи, на очень старой стадии их экспрессия была сопоставима с возрастными когортами (рис. 5p,q), что подтверждает активацию митогормезиса у рыб позднего возраста. Поскольку было показано, что ограничение калорий и АФК запускают митогормезис путем усиления сигнального пути сиртуина (Chen et al., 2005; Cohen et al., 2004; Heidler et al., 2009; Schmeisser et al., 2013) (обзор в [Ristow & Schmeisser, 2014]), мы исследовали уровни сиртуина 1 (sirt1). Действительно, мы наблюдали значительное увеличение экспрессии sirt1 у 52-недельных рыб позднего возраста по сравнению с 22-недельными ранними и 37-недельными когортами (рис. 5r). Наконец, мы также наблюдали значительное увеличение коактиватора транскрипции, активируемого пролифератором пероксисомы, рецептор-гамма-коактиватор 1-α (PGC1α ) (рис. 5r), известной мишени Sirt1, который регулирует митохондриальный биогенез и метаболизм. В совокупности эти результаты подтверждают роль АФК-опосредованного митогормезиса и активацию Sirt1 в увеличении продолжительности жизни очень старой когорты позднего возраста.
Распределение капель липидов изменено у очень старых киллифи позднего возраста.
В то время как высокие уровни внутриклеточного содержания липидов часто связаны с метаболическими патологиями, такими как сахарный диабет 2 типа и ожирение (Bonen et al., 2000; Jacob et al., 1999; Pan et al., 1997), накопление ТГ у спортсменов Было показано, что тренажеры на выносливость улучшают чувствительность к инсулину (Goodpaster et al., 2001; Jacob et al., 1999; Schenk & Horowitz, 2007), явление, известное как парадокс атлета. Различные эффекты накопления ТГ частично опосредованы различиями в динамике липидных капель: у пациентов с диабетом липиды накапливаются в больших субсарколеммальных (СС) липидных каплях, а запасы липидов у спортсменов обогащены более мелкими, но более многочисленными межмиофибриллярными (ИМ) каплями (Daemen et al. др., 2018). Учитывая, что накопление ТГ после тренировки опосредуется PGC1α (Koves et al., 2012), который также активируется в мышцах очень старых киллифишей, мы предположили, что они могут демонстрировать локализацию липидных капель, сходную со спортсменами, и это может быть ключевым фактором, предотвращающим метаболические патологии и смертность, а вместо этого способствующим их выживанию. Чтобы оценить это, мы использовали краситель Bodipy (493/503) для визуализации распределения липидных капель в 22-, 37- и 52-недельных образцах мышц (рис. 6a–c). В соответствии с нашей гипотезой через 22 недели в большинстве волокон наблюдалось одинаковое распределение локализованных капель SS и IM, при этом очень немногие из них не имели явного окрашивания (рис. 6a, d). Напротив, через 37 недель в большинстве волокон не было явного окрашивания Бодипи (рис. 6b, d). Интересно, что, несмотря на увеличение уровней ТГ в 52-недельных образцах позднего периода жизни, примерно 30% волокон были оценены как не имеющие явного окрашивания (рис. 6c, d). Это говорит о том, что увеличение запасов ТГ на поздних стадиях жизни неоднородно, и одни волокна накапливают ТГ больше, чем другие. Однако в волокнах, демонстрирующих накопление ТГ, мы наблюдали поразительное увеличение числа клеток, демонстрирующих локализацию ИМ, и клеток, демонстрирующих одинаковое распределение СС и ИМ на 52-недельной стадии по сравнению с 37-недельными рыбами (рис. 6в, г). Далее мы оценили, связаны ли наблюдаемые изменения в распределении липидов с размером волокна. Для этого мы объединили нашу стратегию тепловой карты размера волокон с окрашиванием Bodipy и оценили распределение липидов в 20–30 мышечных клетках каждой из трех категорий размеров. В соответствии с приведенным выше анализом всех мышечных клеток, большинство мелких (рис. 6e), средних (рис. 6f) и крупных (рис. 6g) волокна показали одинаковое распределение локализованных капель SS и IM через 22 недели. Однако на 37-й неделе каждый из трех размеров волокон продемонстрировал увеличение количества клеток без видимого окрашивания и обратное уменьшение количества клеток, демонстрирующее одинаковое распределение локализованных капель SS и IM. Наконец, на 52-й неделе наблюдалось значительное уменьшение количества мелких, средних и крупных клеток без явного окрашивания, хотя только в мелких волокнах наблюдалось значительное увеличение локализованных капель SS и IM. В совокупности эти результаты подчеркивают, что запасы TG не только увеличиваются у очень старых животных, но также происходит сдвиг в распределении капель TG, что приводит к увеличению IM и одинаково распределенных локализованных пулов SS и IM.
Рис. 6
Распределение капель липидов изменено у очень старых киллифи позднего возраста. (a–c) Репрезентативные изображения внутриклеточных липидных капель, помеченных Bodipy (493/503) (зеленый), Dapi (синий) и агглютинин зародышей пшеницы (WGA) (красный) через 22 недели, 37 недель и 52 недели. -недельная мышца. Также отображается тепловая карта распределения размеров волокон для каждого животного. Увеличив изображение, можно выделить различные пулы липидов: отсутствие явного окрашивания Bodipy (493/503) (^), преимущественно субсарколеммальное (SS) окрашивание (стрелка), преимущественно межмиофибриллярное (IM; #) или одинаковое распределение локализации SS и IM (*). (d) Процент всех мышечных волокон, не демонстрирующих явного окрашивания Bodipy, преимущественно SS, преимущественно IM или одинаковое распределение локализации SS и IM. Столбики погрешностей представляют ± SD. (e) Процент мелких мышечных волокон, не имеющих явного окрашивания Бодипи, преимущественно СС, преимущественно ИМ или равное распределение локализации СС и ИМ. Столбики погрешностей представляют ± SD. (f) Процент средних мышечных волокон, не демонстрирующих явного окрашивания Bodipy, преимущественно SS, преимущественно IM или одинаковое распределение локализации SS и IM. Столбики погрешностей представляют ± SD. (g) Процент всех мышечных волокон, не демонстрирующих явного окрашивания Bodipy, преимущественно SS, преимущественно IM или одинаковое распределение локализации SS и IM. Столбики погрешностей представляют ± SD. * (g) Процент всех мышечных волокон, не демонстрирующих явного окрашивания Bodipy, преимущественно SS, преимущественно IM или одинаковое распределение локализации SS и IM. Столбики погрешностей представляют ± SD. * (g) Процент всех мышечных волокон, не демонстрирующих явного окрашивания Bodipy, преимущественно SS, преимущественно IM или одинаковое распределение локализации SS и IM. Столбики погрешностей представляют ± SD. *р < 0,05; ** р < 0,01; и **** p <0,0001, рассчитанное с использованием двухфакторного дисперсионного анализа с апостериорным тестом множественной коррекции Тьюки.
Краткосрочное лечение ресвератролом и последующая активация Sirt1 у старых рыб-киллифов приводят к фенотипу, подобному позднему возрасту.
Основываясь на наших результатах, мы предлагаем следующую модель увеличения продолжительности жизни очень старых животных: во время старения истощение триглицеридов увеличивает АФК и окислительный стресс, который запускает митогормезис. В результате происходит значительное увеличение экспрессии Sirt1 и PGC1 α в пожилом возрасте, что не только увеличивает экспрессию генов антиоксидантов, тем самым снижая окислительный стресс, но и улучшает метаболизм липидов, включая более эффективное распределение липидных капель. Эта модель предполагает активацию Sirt1 в поддержании гомеостаза питательных веществ и замедлении показателей смертности. Чтобы функционально проверить эту модель, мы лечили 33-недельных киллифишей хорошо охарактеризованным индуктором Sirt1 ресвератролом (Ma et al., 2020; Nishigaki et al., 2020 ; Yang et al., 2019) в течение 4 недель и 37 недель мы исследовали их метаболом, сосредоточив внимание на метаболизме липидов. Мы предположили, что лечение ресвератролом приведет к увеличению экспрессии Sirt1 у стареющих животных, что, согласно нашей модели, достаточно для развития фенотипа позднего возраста у животных, получавших лечение. Исследование размера тела не выявило изменений в длине, но значительно увеличило массу тела самцов, получавших ресвератрол, по сравнению с контрольными самцами, получавшими носитель (рис. 7a,b). Важно отметить, что используемый режим лечения ресвератролом был достаточным для индукции значительного увеличения уровней мРНК Sirt1 (рис. 7c).
Рис. 7
Кратковременное лечение ресвератролом и последующая активация sirt1 у старых киллифи приводит к фенотипу, подобному позднему возрасту. Количественное определение длины тела (а) и веса (б) контрольной и обработанной ресвератролом рыбы 37-недельного возраста. Столбики погрешностей представляют ± SD. (c) Уровни экспрессии генов sirt1в контрольной группе и рыбе 37-недельного возраста, получавшей ресвератрол. Столбики погрешностей представляют ± SEM. (d) Главный компонент анализирует график оценки всех метаболитов, идентифицированных в мышечных лизатах, обработанных контрольным (красным) и ресвератролом (зеленый). (e) Общая интенсивность триглицеридов (ТГ) у контрольных животных и животных, получавших ресвератрол. Столбики погрешностей представляют ± SD. (f–g) Репрезентативные изображения внутриклеточных липидных капель, помеченных Bodipy (493/503) (зеленый) и агглютинин зародышей пшеницы (WGA) (красный) у контрольной рыбы и рыбы, получавшей ресвератрол. (h) Процент всех мышечных волокон, не демонстрирующих явного окрашивания Bodipy, преимущественно SS, преимущественно IM или одинаковое распределение локализации SS и IM в контрольной и обработанной ресвератролом мышце. Столбики погрешностей представляют ± SD. * p < 0,05 рассчитано с использованием непарного tтест (односторонний) (a–e) или непарный t- критерий с методом множественного сравнения Холма – Шидака (h). (i) Схема предлагаемых механизмов, способствующих замедлению смертности. Создано с BioRender.com.
Подтвердив индукцию уровней sirt1, мы провели нецелевой метаболомический анализ, сравнив метаболом рыбы, получавшей ресвератрол, с метаболомом контрольных животных, идентифицировав 1398 предполагаемых метаболитов в 14 образцах (семь контрольных и семь животных, получавших ресвератрол). График PCA для всех метаболитов показал четкую кластеризацию контрольной группы и группы, получавшей ресвератрол, что подчеркивает их различные метаболические состояния (рис. 7d). Это было особенно примечательно, учитывая короткий 4-недельный курс лечения. Учитывая, что липидный обмен был наиболее поразительной разницей, наблюдаемой между стадиями старения и позднего возраста, мы затем изучили, как он изменился после лечения ресвератролом. Как и в предыдущих анализах, мы определили общее содержание каждого типа липидов, добавив интенсивность пиков всех значительно измененных метаболитов в этом подтипе. В соответствии с нашей моделью, наши анализы выявили значительное повышение уровня триглицеридов у самцов, получавших ресвератрол, по сравнению с контрольными животными (рис. 7e). Хотя мы не наблюдали различий в уровнях DG (расширенные данные, рис. 5a в данных S1), мы наблюдали небольшое, почти значительное снижение CDP холина, что позволяет предположить, что, как и на поздних стадиях жизни (расширенные данные, рис. 5b в данных S1) , у животных, получавших ресвератрол, наблюдается снижение синтеза ФХ, что может привести к снижению липолиза и последующему ТГ. накопление. Кроме того, у животных с ресвератролом были изменены различные другие подклассы липидов. Это включает значительное снижение уровней PC (расширенные данные, рис. 5c в данных S1), PE (расширенные данные, рис. 5d, данные S1) и PS (расширенные данные, рис. 5f, данные S1), все из которых также снижаются в позднем возрасте. , и повышенные уровни PG (расширенные данные, рис. 5g в данных S1), хотя PI (расширенные данные, рис. 5e в данных S1), а керамиды остаются незатронутыми (расширенные данные, рис. 5h в данных S1). В совокупности эти результаты подчеркивают поразительное сходство липидного состава между животными, получавшими ресвератрол, и животными на поздних стадиях жизни, что подтверждает нашу модель.
Затем мы проверили, изменилось ли, помимо повышенного уровня ТГ, распределение липидов у животных, получавших ресвератрол. С этой целью мы оценили локализацию липидных капель в контрольных и обработанных ресвератролом мышечных волокнах по одной из четырех категорий: отсутствие видимого окрашивания, преимущественно IM, преимущественно SS и одинаковое распределение IM и DD. В соответствии с изменениями, наблюдаемыми в позднем возрасте, мы наблюдали значительное уменьшение количества волокон, не демонстрирующих явного окрашивания, у животных, получавших ресвератрол (по сравнению с контролем), и это сопровождалось небольшим, незначительным увеличением преимущественно ИМ и равным Волокна IM и SS (рис. 7f–h). В совокупности эти данные предоставляют функциональные доказательства роли Sirt1 в регуляции метаболизма липидов в пожилом возрасте, тем самым подтверждая нашу модель роли митогормезиса в регуляции замедления смертности.
ОБСУЖДЕНИЕ
В этом исследовании мы продемонстрировали, что киллифи демонстрируют многие признаки саркопении, в том числе атрофию мышечных волокон, измененный протеолиз, уменьшение количества стволовых клеток и денервацию, тем самым предоставив крайне недолговечную модельную систему позвоночных для изучения биологии саркопении. с высокой повторяемостью и осуществимостью.
Благодаря нашим обширным экспериментам по характеристике мы также обнаружили, что, хотя многие из этих характеристик ухудшаются с возрастом, небольшое количество характеристик — размер волокон и протеолиз — улучшаются в когортах позднего возраста, что совпадает со снижением уровня смертности. Это говорит о том, что у очень старых животных могут существовать механизмы, предотвращающие дальнейшее ухудшение здоровья скелетных мышц, что в конечном итоге способствует увеличению продолжительности их жизни. Действительно, для многих организмов было сообщено, что, хотя старение первоначально характеризуется экспоненциальным увеличением смертности, на более поздних этапах взрослой жизни уровень смертности либо выходит на плато, либо даже снижается, явление, называемое замедлением смертности (Barbi et al., 2018; Кэри и др., 1992; Чен и др., 2013; Куртсингер и др., 1992; Шахрестани и др., 2009 ; Вопель и др., 1998). Существование замедления смертности интригует, поскольку предполагает, что после определенного момента времени старение может прекратиться или даже повернуться вспять. Наши данные о том, что уровень смертности снижается на уровне популяции на поздних стадиях жизни, показывают, что у килли также наблюдается замедление смертности. Таким образом, киллифиш представляет собой новую модель для изучения механистической основы этого явления у позвоночных с представленным здесь метаболомическим анализом, в котором подробно описывается метаболический статус скелетных мышц в каждый из трех моментов времени, что является первой попыткой достижения этой цели. Наши анализы выявили центральную роль метаболизма липидов в регуляции замедления показателей смертности на очень старых, поздних стадиях жизни. Основываясь на наших наблюдениях и ранее опубликованной литературе, 7i): Во время старения запасы ТГ истощаются, что приводит к уменьшению доступности питательных веществ и энергии, что вызывает увеличение производства АФК, ответ, который обычно наблюдается после режимов ограничения калорий. Это, в сочетании с уменьшением митохондриальных комплексов OXPHOS, активирует митогормезис у небольшого количества рыб, что приводит к увеличению экспрессии sirt1 , который опосредует множественные молекулярные изменения ниже по течению, впоследствии увеличивающие продолжительность жизни. Действительно, мы показали, что активация sirt1 после лечения ресвератролом была достаточной, чтобы индуцировать метаболический профиль, подобный позднему возрасту, у старых животных, подтверждая его роль в замедлении смертности. Кроме того, оба ресвератрола (Valenzano et al., 2006) и диетические ограничения (Terzibasi et al., 2009 ) не только уменьшают возрастные патологии у киллифи, включая улучшение обучения и памяти, снижение нейродегенерации и снижение накопления липофусцина, но и продлевают максимальную продолжительность жизни. В совокупности эти результаты подчеркивают роль Sirt1 в регуляции метаболических изменений, наблюдаемых на поздних стадиях жизни.
Согласно опубликованным данным, повышенный Sirt1 имеет многочисленные последующие эффекты, многие из которых также были очевидны в очень старой когорте (рис. 7i). К ним относятся: повышенная экспрессия генов антиоксидантов, снижающая окислительный стресс в пожилом возрасте (Pardo et al., 2010); индукция аутофагии, которая уменьшает атрофию мышц и способствует долголетию (Hansen et al., 2018); и повышенная экспрессия PGC1α (Rodgers et al., 2005), главного регулятора липидного и митохондриального метаболизма. Также было показано, что индукция PGC1α имеет несколько последующих эффектов: повышенная экспрессия генов антиоксидантов, включая SOD и GPX., тем самым способствуя снижению окислительного стресса в пожилом возрасте (St-Pierre et al., 2006); Ингибирование экспрессии убиквитинлигазы, в том числе атрогина-1, с последующим снижением протеолитической деградации белков и, таким образом, предотвращением дальнейшей мышечной атрофии на поздней стадии жизни (Brault et al., 2010; Sandri et al., 2006); и измененный метаболизм липидов (Gerhart-Hines et al., 2007; Wu et al., 1999), чистым эффектом которого является накопление ТГ в когорте позднего возраста. Важно отметить, что внутриклеточные липиды хранятся в более мелких, более обильных межмиофибриллярных (IM) каплях, которые, как было показано, улучшают использование для получения энергии, и возможно, что то же самое происходит на поздних стадиях жизни, что впоследствии приводит к поддержанию питательных веществ и энергетический гомеостаз. Поэтому мы утверждаем, что хотя высокий уровень внутриклеточного содержания липидов часто связан с метаболическими патологиями, накопление ТГ в мышцах позднего возраста может быть ключевым фактором, предотвращающим метаболические патологии и последующую смертность и способствующим выживанию. Действительно, было показано, что мыши дикого типа, которые менее эффективно мобилизуют жиры, живут дольше (Liao et al., 2011). Кроме того, было показано, что увеличение количества определенных типов пищевых жиров увеличивает продолжительность жизни и улучшает митохондриальную динамику в стареющих скелетных мышцах (Gutiérrez-Casado et al., 2018), подчеркивая, что поддержание ожирения может способствовать долголетию.
Идентификация того, что митогормезис и передача сигналов Sirtuin активны на стадиях, когда уровень смертности снижается, является захватывающим открытием. Действительно, было показано, что АФК и митогормезис после фармакологических и/или генетических манипуляций увеличивают продолжительность жизни на различных моделях позвоночных (Cox et al., 2018; Ost et al., 2014; Weimer et al., 2014), подтверждая их роль в регуляции чрезвычайно старая, поздняя стадия жизни. Кроме того, было показано, что сверхэкспрессия ортологов сиртуина увеличивает продолжительность жизни у многих видов (Kaeberlein et al., 1999; Mouchiroud et al., 2013; Rogina & Helfand, 2004; Schmeisser et al., 2013; Tissenbaum & Guarente, 2001). Однако наши результаты указывают на возникновение митогормезиса у позвоночных, которые в природе живут дольше, и предполагают его роль в увеличении продолжительности жизни в естественных популяциях позвоночных. Следовательно, повышенная способность реагировать на стресс может быть основной эволюционной детерминантой долголетия и лежать в основе существования замедления смертности в пожилом возрасте.
В заключение мы предполагаем, что АФК-зависимый митогормезис и активация Sirt1 и PGC1α улучшают продолжительность здоровья мышц при старении, обеспечивая механизм увеличения продолжительности жизни у очень старых животных. Важно отметить, что наши результаты подчеркивают, что некоторые из метаболических признаков старения могут исчезнуть после определенного момента, что является захватывающей перспективой, учитывая социальные, экономические и медицинские расходы, связанные с постоянно растущим пожилым населением во всем мире. Таким образом, модель киллифиша не только предоставляет чрезвычайно короткоживущих позвоночных для изучения биологических процессов, управляющих старением, включая саркопению, но также предоставляет уникальную модель для понимания регуляции долголетия и процессов, контролирующих замедление смертности.
МЕТОДЫ
Экспериментальная модель и детали предмета
Штамм Nothobranchius furzeri MZCS_08/122 использовался для всех описанных здесь экспериментов, и рыба была первоначально получена от селекционера для исследовательских целей (2010/63/EU). Чтобы избежать каких-либо смешанных эффектов яйценоскости, которая, как известно, влияет на обмен веществ, на каждом из четырех этапов (6-недельный, 22-недельный, 37-недельный и 52-недельный) исследовали только самцов рыб. Рыб содержали при 26°C в цикле 12 часов свет:12 часов темнота. Рыб кормят дифференцированно в зависимости от их возраста: от вылупления (0 дней после оплодотворения) до 3–4 недель после вылова животных кормят Artemia salina два раза в день; молодь (от 4 до 12 недель) кормят Chironomidae spp, личинки один раз в день и Artemia salinaдва раза в день; а взрослых (начиная с 12 недель) кормят личинками Chironomidae spp один раз в день. Животные содержатся либо группами в обычных 20-литровых аквариумах, либо поодиночке в 5-литровых аквариумах (разделены на два: 2,5 л на рыбу), так что максимальное количество рыб на литр составляет 1. Здоровье рыб, включая кормление поведения, контролировали ежедневно, и у рыб, использованных в этом исследовании, не было выявлено вирусных или паразитарных инфекций. Все животные содержались в соответствии с действующей версией Закона Германии о защите животных.
Коллекция тканей
Рыб забивали инкубацией в растворе метансульфоната трикаина с концентрацией 1 г/л в течение 10 мин. Чтобы избежать влияния циркадных ритмов и кормления, животных всегда забивали между 10:00 и 12:00 натощак. Измеряли длину и вес каждой рыбы, после чего мышцу вырезали и либо фиксировали в 4% параформальдегиде (4% PFA), а затем заливали в парафин или среду ОСТ, либо быстро замораживали путем погружения в жидкий азот.
Иммунофлуоресцентное окрашивание
Мышцы, залитые ОКТ, делали срезы с использованием криостата Leica CM 1850, и срезы помещали на предметные стекла, покрытые полилизином, которые хранили при -80 до готовности к окрашиванию. Срезы оттаивали, помещая при комнатной температуре на 30 минут, фиксировали 4% PFA в течение 5 минут, а затем трижды промывали в фосфатно-солевом буфере (PBST). Затем срезы инкубировали в блокирующей среде в течение 30 мин, а затем инкубировали в течение ночи в блокирующем растворе, содержащем соответствующее антитело. Первичные антитела, используемые в этом исследовании, включают: анти-коллаген 1 (Abcam, ab23730, 1/300), анти-pax7 (Santa Cruz, sc-81,648, 1:100), анти-синаптический везикулярный гликопротеин 2A (SV2, DSHB, 1 /10), антимиозиновые (маркировка медленных и быстрых миозинов, A4.1025, DSHB, 1/10) и антимедленные миозины (F59, DSHB, 1/10). Первичное антитело промывали не менее шести раз PBST. после чего препараты инкубировали во вторичных антителах в течение 2 часов. Используются следующие вторичные антитела: AlexaFluor™-меченый-488, AlexaFluor™-меченый-546 и/или AlexaFluor™-меченый-596 (Invitrogen, 1:300). Dapi (Sigma, D8417, конечная концентрация 3 мкг/мл) использовали для контрастного окрашивания ядер, конъюгированный краситель α-бунгаротоксина 594 (Biotium, 00007, конечная концентрация 2 мкг/мл) использовали для мечения никотиновых ацетилхолиновых рецепторов, Bodipy (493/503 ) (ThermoFisher Scientific, D3922, конечная концентрация 10 мкг/мл) для липидных капель и конъюгированного агглютинина зародышей пшеницы (Vector Labs; RL-1022 1:300 или Invitrogen, W32466, конечная концентрация 5 мкг/мл) для маркировки мышечных мембран. Окрашенные срезы помещали в SlowFade (ThermoFisher Scientific, S36963) монтажной среды или 80% глицерина, а затем визуализировали с помощью конфокального микроскопа Zeiss LSM 710 (срезы, окрашенные SV2 и α-бунгаротоксином), составного микроскопа Zeiss Z1 (срезы, окрашенные коллагеном), Leica DMI AF6000LX (A4.1025 и срезы, окрашенные F59), или микроскоп Leica Thunder Deconvolution (срезы, окрашенные Pax7/WGA/Dapi, и срезы, окрашенные Bodipy/WGA (493/503)). Анализ данных и прогнозы максимальной интенсивности (где это уместно) были получены с использованием Фиджи (http://fiji.sc ).
Выделение белка и эксперименты по вестерн-блоттингу
Белковые лизаты получали согласно Boglev et al., 2013; Рупарелия и др., 2016 и количественно с использованием флуорометрического количественного определения Qubit (Thermo Fisher Scientific). Общее количество 20–30 мкг каждого образца вместе с восстановителем (Life Technologies) и красителем для загрузки белка (Life Technologies) нагревали при 70°C в течение 10 мин, разделяли с помощью SDS-PAGE на NuPAGE 4–12% гели Bis-Tris (для окрашивания LC3, p62 и F310) или ацетатные гели NuPAGE Tris (для окрашивания F59) и переносили на мембрану PVDF (Millipore). После переноса мембрану блокировали 5% обезжиренным молоком в PBST или TBST, а затем исследовали одним из следующих первичных антител: анти-LC3 (Cell Signaling, 12,741, 1/2000), анти-p62 (Cell Signaling, 51,142, 1/1000), антитела против VDAC1 (Abcam, ab154856, 1/1000), антитела против тяжелой цепи медленного миозина (DSHB, A4/1025, 1/10) и антитела против легкой цепи миозина 1/3 (DSHB, F310 , 1/10). Следующим утром, первичное антитело промывали и мембрану инкубировали с соответствующим конъюгированным с HRP вторичным антителом (1:10000, Southern Biotech). Иммуноблоты были разработаны с использованием ECL prime (GE Healthcare) и визуализированы с использованием хемилюминесцентного детектора (Vilber Lourmat). Затем мембрану удаляли путем инкубации в 1X буфере для удаления (200 мМ глицин, 0,1% SDS, 1% Tween20 и pH 2,2) дважды в течение 10 минут, промывали в PBST и окрашивали Direct blue согласно Zeng et al. ( 2) дважды по 10 мин, отмывали в PBST и окрашивали прямым синим по Zeng et al. ( 2) дважды по 10 мин, отмывали в PBST и окрашивали прямым синим по Zeng et al. (2013 ) для определения общего белка. Блот-изображения были количественно оценены с использованием программного обеспечения Image Lab (Bio-Rad) и однофакторного статистического теста ANOVA для проверки значительных изменений уровней белка.
Экстракция РНК, синтез кДНК и количественная ОТ-ПЦР
Моментально замороженные скелетные мышцы подвергали криогенному измельчению (криопульверизация) с использованием 12-луночного биопульверизатора (BioSpec Products, OK USA, номер детали 59012MS) в соответствии с инструкциями производителя. Вкратце, биопульверизатор и пестики охлаждали путем погружения в жидкий азот. Затем замороженные образцы добавляли в лунку и измельчали, нанося по пестику четыре или пять резких ударов молотком. Затем порошкообразную ткань переносили шпателем, охлажденным в жидком азоте, в холодную пробирку Эппендорфа на сухом льду. Тотальную РНК экстрагировали из порошкообразной ткани с использованием реагента TRI (Sigma, 93,289), а затем кДНК синтезировали с использованием набора для синтеза кДНК iScript (Bio-Rad, 1,708,891). Количественную ОТ-ПЦР (qRT-PCR) проводили с использованием амплификатора Mic qPCR (Bio Molecular Systems) с использованием SYBR Green Master mix (Life Technologies Australia, 4,364,346). Все праймеры были протестированы, чтобы гарантировать амплификацию одного продукта размером 150–200 п.н. Последовательности всех использованных праймеров перечислены в расширенной таблице данных 3 в разделе «Данные».
Моделирование набора данных о продолжительности жизни
Используя данные о выживаемости из нашего ранее опубликованного анализа продолжительности жизни (Wendler et al., 2015), мы рассчитали совокупную смертность каждую неделю, которая затем была преобразована в логарифмическую шкалу. Точки перегиба данных логарифмической шкалы смертности для мужчин и женщин оценивались на основе метода оценки экстремальной поверхности с использованием пакета R для перегиба ( https://cran.r-project.org/package=inflection ). Этот метод работает на основе лемм, определенных в (Christopoulos, 2016 ).
Метаболомические эксперименты
4.7.1 Подготовка проб
Образцы были рандомизированы и ослеплены перед подготовкой к метаболическому анализу. Мгновенно замороженные мышцы подвергали криогенному измельчению, как обсуждалось выше. Затем замороженную ткань взвешивали путем переноса в свежую пробирку Эппендорфа и 20 мкл охлажденного льдом растворителя для экстракции (2:6:1 CHCl 3 :MeOH:H 2 O об./об./об. с 2 мкМ CHAPS, CAPS, PIPES, и ТРИС в качестве внутренних стандартов) на мг ткани сразу добавляли. Затем смесь ненадолго встряхивали перед обработкой ультразвуком на бане со льдом и водой в течение 10 минут, после чего ее центрифугировали (20 000 центробежных сил, 4°C, 10 минут). Супернатант переносили в пробирку для масс-спектрометрии для последующей жидкостной хроматографии в сочетании с анализом масс-спектрометрии высокого разрешения (ЖХ-МС).
Жидкостная хроматография в сочетании с масс-спектрометрическим анализом высокого разрешения
Образцы анализировали с помощью гидрофильной жидкостной хроматографии в сочетании с масс-спектрометрией высокого разрешения (ЖХ-МС) в соответствии с ранее опубликованным методом (Stoessel et al., 2016). Вкратце, хроматографию проводили с использованием градиентного элюирования 20 мМ карбоната аммония (А) и ацетонитрила (В) (время линейного градиента — %В следующим образом: 0 мин — 80%, 15 мин — 50%, 18 мин — 5% , 21 мин-5%, 24 мин-80% и 32 мин-80%) при 25°C на УВЭЖХ Dionex RSLC3000 (Thermo Fisher Scientific) с использованием колонки SeQuant ZIC-p(HILIC) 150 × 4,6 мм (Merck ). Скорость потока поддерживали на уровне 300 мкл/мин. Образцы хранили при температуре от 4°C до 6°C в автоматическом пробоотборнике и вводили 10 мкл для анализа. Масс-спектрометрию проводили либо на Q-Exactive Orbitrap, либо на Q-Exactive Plus MS (Thermo Fisher Scientific), работающем в быстром переключении положительного (4 кВ) и отрицательного (-3,5 кВ) режима ионизации электрораспылением (температура капилляра 300°C; защитный газ 50; вспомогательный газ 20; продувочный газ 2; температура зонда 120°C). Для каждого эксперимента все образцы были проанализированы как одна партия, в случайном порядке и с объединенным контролем качества, образцы регулярно анализировались в течение всей партии для подтверждения воспроизводимости. От 300 до 500 стандартов метаболитов анализировали непосредственно перед партией, чтобы определить точное время удерживания для облегчения идентификации метаболитов. Дополнительное время удерживания для метаболитов, не соответствующих аутентичным стандартам, прогнозировалось с помощью вычислений, как описано ранее (Creek et al., 2011 ).
Митохондриальная изоляция и BN-PAGE
Мгновенно замороженные мышцы киллифиша оттаивали в ледяном растворе А (20 мМ HEPES-KOH pH 7,6, 220 мМ маннита, 70 мМ сахарозы, 1 мМ ЭДТА, 2 мг/мл не содержащего жирных кислот бычьего сывороточного альбумина (Sigma) с добавлением полной, не содержащей ЭДТА коктейльной таблетки ингибитора протеазы [Roche]) и гомогенизировали с помощью 20 взмахов тефлоновым пестиком с просверленным отверстием и стеклянным гомогенизатором. Полученные гомогенаты центрифугировали при 800 g в течение 5 мин при 4°C, супернатант собирали и центрифугировали при 10000 g в течение 10 мин при 4°C. Полученный осадок собирали и ресуспендировали в охлажденном льдом растворе B (20 мМ HEPES-KOH, pH 7,6, 220 мМ маннита, 70 мМ сахарозы, 1 мМ ЭДТА и полный состав, и коктейльная таблетка ингибитора протеазы без ЭДТА [Roche, 11 873 580 001]). . Затем образцы осветляли центрифугированием при 800 g в течение 5 мин при 4°C, полученный супернатант собирали и центрифугировали при 10 000 g в течение 20 мин при 4°C для получения митохондриального осадка. Затем осадок митохондрий ресуспендировали в ледяном буфере для хранения сахарозы (10 мМ HEPES-KOH, pH 7,6, 0,5 М сахарозы) и определяли концентрацию митохондриального белка с помощью набора для анализа белка Pierce BCA (Thermo Fisher Scientific) в соответствии с инструкциями производителя. Митохондрии разделяли на аликвоты и хранили при -80°C до тех пор, пока они не потребуются.
BN-PAGE проводили на изолированных митохондриях, как описано ранее McKenzie et al. (2007). Белковые комплексы, разделенные с помощью BN-PAGE, переносили на мембрану PVDF (Merck) с использованием Power Blotter (Thermo Fisher Scientific) в соответствии с протоколом производителя. Затем мембраны зондировали: анти-NDUFS3 (Molecular Probes, A21343, 1/1000), анти-SDHB (часть коктейля OXPHOS; Abcam, ab110413, 1/1000), анти-ATP5A (часть коктейля OXPHOS, Abcam, ab110413, 1/1000) или анти-VDAC1 (внутреннее антитело, выращенное у кроликов, 1/500). После этого мембрану инкубировали с соответствующим вторичным антителом, конъюгированным с HRP (Sigma-Aldrich, A9044 или A0545, 1/5000). Иммунореактивные комплексы выявляли с использованием хемилюминесцентного субстрата Clarify western ECL (BioRad; 1 705 061) и визуализировали с помощью системы визуализации BioRad ChemiDoc XRS+.
4.9.1 Лекарственное лечение ресвератролом
Эксперименты с лекарствами были одобрены Комитетом по этике животных Монаша (ERM33324) и проводились на взрослых 33-недельных взрослых в течение 4 недель, согласно Valenzano et al., 2006 . с некоторыми модификациями: исходный раствор ресвератрола с концентрацией 0,4 мг/мкл готовили в 5% этаноле. Замороженных личинок Chironomus оттаивали, оставляли стечь и разделяли на аликвоты на отдельные порции по 500 мкг, что достаточно для пяти взрослых рыб. К каждой аликвоте Chironomus добавляли общее количество 120 мкл исходного раствора 0,4 мг/мкл (или 5% этанола для контрольных животных), который оставляли при 4°C на 2 ч для пропитки. Общее количество 100 мкл 5% желатина добавляли к аликвоте хирономуса/ресвератрола, перемешивали, замораживали и хранили при -20°C до использования. Для кормления замороженный кубик желатина/хирономуса оттаивали в воде и скармливали рыбам три раза в день в течение 4 недель. Всю несъеденную пищу удаляли через 20 мин.
Количественная оценка и статистический анализ
Количество независимых биологических повторов, исследованных для каждого эксперимента, использованные статистические тесты и соответствующее значение t /F, степени свободы (df) и точные полученные значения p подробно описаны в таблице расширенных данных 4–10 в данных S1. Для всех экспериментов порядок, в котором собирались данные, был случайным, а идентичность образца была скрыта до завершения анализа.
Количественная оценка и визуализация размера мышечных волокон
Изображения были сегментированы с использованием интерактивного инструмента сегментации ilastik версии 1.4.0b20 (Berg et al., 2019), после чего для определения размеров отдельных мышечные волокна. В общей сложности было проведено 43 307 измерений из двух различных переднезадних положений у 22 разных животных. Каждое измерение было отнесено к одной из трех групп в зависимости от размера: малые (<1000 мкм 2), средние (от 1000 до 2600 мкм 2) и большие (> 2600 мкм 2), после чего была использована обобщенная линейная смешанная модель (с апостериорным тестом Бонферрони) для выявления любых существенных изменений в вероятности больших волокон (по сравнению со средними волокнами) и средних волокон (по сравнению с мелкими волокнами) в четырех возрастных группах. Чтобы визуализировать распределение волокон по размерам, малые, средние и крупные волокна были окрашены в красный, желтый и зеленый цвета соответственно с использованием специально написанного макроса на Фиджи. Все изображения с аннотированными областями интересов были предоставлены на Figshare.
Количественная оценка количества мышечных стволовых клеток
Общее количество 20–30 волокон из каждой размерной группы на каждом изображении было выбрано случайным образом с использованием специально написанного макроса на Фиджи. Затем количество мышечных стволовых клеток Pax7+, прилегающих к выбранным волокнам, определяли вручную с использованием Fiji (http://fiji.sc). Количество Pax7+ мышечных стволовых клеток нормализовали по количеству мышечных клеток, и затем для определения статистической значимости использовали однофакторный дисперсионный анализ с множественной коррекцией Тьюки.
Количественная оценка денервированных концевых пластинок
Количество иннервированных концевых пластинок, идентифицированных по наличию синаптического везикулярного гликопротеина 2А и окрашиванию α-бунгаротоксином, и денервированных концевых пластинок, идентифицированных по отсутствию синаптического везикулярного гликопротеина 2А и окрашиванию α-бунгаротоксином, определяли вручную с помощью Fiji. . Критерий хи-квадрат использовали для выявления статистически значимых изменений доли иннервированных/денервированных концевых пластинок в каждом из четырех случаев.
Количественная оценка распределения капель липидов на основе окрашивания Bodipy (493/503)
Мелкие, средние и крупные мышечные волокна были классифицированы, как указано выше, после чего 20–30 мышечных клеток из каждой группы были случайным образом выбраны (с использованием макроса рандомизатора, описанного выше) у каждой рыбы и распределены в одну из четырех групп: без видимого окрашивания, преимущественно субсарколемное (SS) окрашивание, преимущественно межмиофибриллярное (IM) или равное распределение SS и IM локализации. Двусторонний дисперсионный анализ с апостериорным тестом Тьюки с множественной коррекцией впоследствии использовали для выявления любых статистически значимых изменений в каждой из четырех моделей распределения липидов в трех временных точках.
Анализ данных для эксперимента по метаболомике
Нецелевые данные метаболомики были проанализированы с использованием рабочего процесса IDEOM (версия 20) с параметрами по умолчанию (Creek et al., 2012). Вкратце, это включало выделение пиков с помощью XCMS (Tautenhahn et al., 2008), выравнивание пиков и фильтрацию с помощью mzMatch (Scheltema et al., 2011) с последующей фильтрацией и идентификацией метаболитов с помощью IDEOM. Набор данных был дедуплицирован путем выбора дублирующегося метаболита с самым высоким значением достоверности или, если значение достоверности одинаково, был выбран метаболит с максимальной интенсивностью, а другие были отфильтрованы. Для сравнительного анализа набор необработанных метаболомных данных был преобразован в логарифмическую шкалу 10, а затем был выполнен анализ основных компонентов (PCA) и иерархическая кластеризация с использованием веб-инструмента MetaboAnalyst 3.0 (Chong et al., 2019) .). Для анализа тенденций набор необработанных данных был преобразован в логарифмическую шкалу 2, после чего вариации содержания метаболитов в трех временных точках оценивались на основе четырех групп тенденций, включая повышающую регуляцию, понижающую регуляцию, колоколообразную и U-образную, которые в целом состояли из из 17 различных типов трендов. С этой целью к данным метаболомики был применен однофакторный дисперсионный анализ (ANOVA), за которым последовал тест Тьюки HSD (честно значимая разница) для множественных попарных сравнений, и каждому метаболиту был присвоен тип тренда на основе его среднего содержания в разные моменты времени. Для всех этих анализов значение р <0,05 считалось статистически значимым.
Совместное содержание метаболитов оценивали путем расчета корреляции содержания метаболитов во всех образцах всех временных точек с использованием алгоритма Пирсона. Затем все парные метаболиты с коэффициентом корреляции Пирсона ( r )>0,7 и скорректированным значением p <0,01 были выбраны как значимые сопутствующие метаболиты. Впоследствии была реконструирована ассоциативная сеть на основе совместного содержания метаболитов с использованием программного обеспечения Cytoscape v.3.7.1 (Shannon et al., 2003). Топологию сети анализировали с помощью программного обеспечения Cytoscape, а для идентификации функциональных модулей метаболитов использовали алгоритм марковской кластеризации (MCL). Также была рассчитана интегральная величина влияния (IVI) каждого метаболита на основе метода IVI (Salavaty et al., 2020), с использованием «влиятельного» пакета R (https://cran.r-project.org/package = влиятельный). Баллы IVI для всех метаболитов представлены в репозитории Figshare. Предполагаемая идентичность 20 наиболее влиятельных метаболитов была подтверждена ручной обработкой данных ЖХ-МС, что привело к удалению пяти из этих метаболитов, которые были идентифицированы как артефакты масс-спектрометрии. Таким образом, было представлено только 15 метаболитов. Кроме того, была реконструирована сеть на основе метаболитов, принадлежащих трендовым типам колоколообразной группы, и аналогичным образом был рассчитан IVI каждого узла.