Описание
Препарат Хумира — современный иммунодепрессант, с основным действующим веществом Адалимумаб. Адалимумаб представляет собой рекомбинантное моноклональное антитело, относящееся к классу иммуноглобулинов (IgG1) и содержащее только пептидные последовательности человека. С высоким сродством и специфичностью адалимумаб связывается c фактором некроза опухоли альфа (ФНО-α), цитокином, который известен способностью управлять воспалительным ответом во многих тканях, поражающихся при аутоиммунных заболеваниях.
Состав Хумира
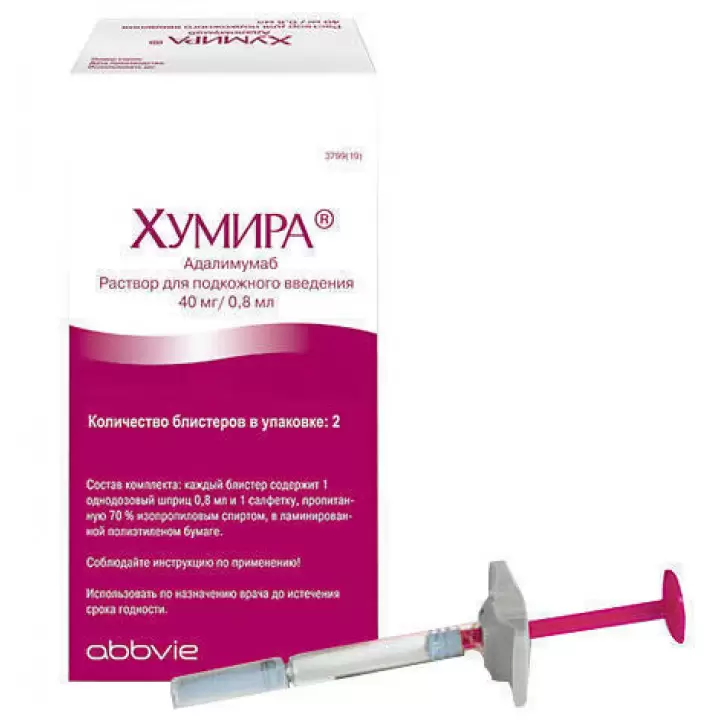
Раствор для подкожного введения, 40 мг/0,4 мл.
• Действующее вещество: адалимумаб — 40,0 мг;
Вспомогательные вещества: маннитол, натрия цитрат, моногидрат лимонной кислоты, натрия гидрофосфата дигидрат, натрия дигидрофосфата дигидрат, натрия хлорид, полисорбат 80, вода для инъекций, натрия гидроксид для коррекции рН.
Показания к применению Хумира
Взрослые
- умеренный и тяжелый активный ревматоидный артрит (в режиме монотерапии или в комбинации с метотрексатом или другими базисными противовоспалительными препаратами). Препарат Хумира в комбинации с метотрексатом улучшает функциональную активность и снижает скорость прогрессирования повреждения суставов (по данным рентген исследований);
- псориатический артрит активный (в режиме монотерапии или в комбинации с метотрексатом или другими базисными противовоспалительными препаратами);
- анкилозирующий спондилит активный;
- болезнь Крона (умеренной или тяжелой степени);
- хронический бляшечный псориаз (умеренной и тяжелой степени), когда другие варианты системной терапии не оптимальны;
- язвенный колит умеренной и тяжелой степени при неадекватном ответе на традиционную терапию и при непереносимости к традиционной терапии;
- аксиальный спондилоартрит;
- активный гнойный гидраденит умеренной или тяжелой степени.
Дети
- у пациентов в возрасте от 2 лет ювенильный идиопатический артрит;
- у пациентов в возрасте от 6 лет и старше болезнь Крона (среднетяжелой и тяжелой степени);
- у пациентов в возрасте от 6 лет и старше активный энтезит-ассоциированный артрит.
Фармакодинамика
При лечении препаратом Хумира отмечалось быстрое снижение уровня острофазных показателей воспаления скорости оседания эритроцитов (СОЭ)), уровня цитокинов (ИЛ-6) и (С-реактивного белка (СРВ) в сыворотке крови по сравнению с исходными показателями у пациентов с ревматоидным артритом.
В сыворотке крови уровень матриксных металлопротеиназ (ММР-1 и ММР-3), вызывающих видоизменение тканей, лежащее в основе разрушения хряща, после введения препарата Хумира также снизился. Отмечалось, как правило, улучшение гематологических признаков хронического воспаления у пациентов, получавших лечение препаратом Хумира.
У пациентов с язвенным колито, полиартикулярным ювенильным идиопатическим артритом, гнойным гидраденитом и болезнью Крона,после лечения препаратом Хумира также наблюдалось быстрое снижение уровня СРВ.
Адалимумаб избирательно связывается с ФНОα и за счет блокады взаимодействия с поверхностными клеточными р55 и р75 рецепторами к ФНОα нейтрализует его биологические функции. В развитии патологического воспаления и разрушения суставной ткани, характерных для этих заболеваний ФНОα играет важную роль.
Также биологические ответные реакции, которые индуцируются или регулируются ФНОα, включая изменения содержания молекул адгезии, вызывающих миграцию лейкоцитов модулирует Адалимумаб.
Быстрое снижение концентраций острофазных показателей воспаления (С-реактивного белка и СОЭ) и сывороточных концентраций цитокинов (интерлейкин-6) вызывает адалимумаб у больных ревматоидным артритом. также наблюдалось у пациентов с ювенильным идиопатическим артритом или болезнью Крона уменьшение содержания С-реактивного белка.
Фармакокинетика
Всасывание
Всасывается и распределяется Адалимумаб медленно и достигает сывороточной максимальной концентрации примерно через 5 дней. При однократном п/к введении 40 мг адалимумаба абсолютная биодоступность препарата составляет 64 процента.
Распределение и выведение
объем распределения при однократном в/в введении составляет от 4.7 до 6 л, что указывает на практически одинаковое распределение адалимумаба во внесосудистых жидкостях и в крови. Выводится адалимумаб медленно, клиренс обычно не превышает 12 мл/ч. В среднем период полувыведения варьирует от 10 до 20 дней и составляет 2 недели. Период полувыведения и клиренс существенно не меняются при введении препарата в дозе 0.25-10 мг/кг, а период полувыведения сходен при подкожном и внутривенном введении. Концентрация адалимумаба в синовиальной жидкости у пациентов с ревматоидным артритом составляет 31-96% от таковой в сыворотке.
Фармакокинетика в особых клинических случаях
Применение при беременности и кормлении грудью
В дозировках до 100 мг/кг в исследованиях на животных не было выявлено признаков негативного действия адалимумаба на плод. У беременных женщин, однако, в доказательных контролируемых исследованиях препарат не изучался, поэтому при беременности использование адалимумаба противопоказано.
Нет сведений об элиминации адалимумаба с грудным молоком или его всасывании после приема внутрь.
Многие иммуноглобулины проникают в грудное молоко. У новорожденного возможен риск развития серьезных побочных эффектов. Не рекомендуется кормление грудью в период лечения адалимумабом и после последней инъекции в течение как минимум 5 месяцев.
Применение у детей
В терапии идиопатического ювенильного артрита у детей и подростков в возрасте от 4 лет до 17 лет и болезни Крона (умеренной или тяжелой степени) у пациентов в возрасте от 6 лет и старше
Применение у пожилых пациентов
В связи с высокой вероятностью возникновения инфекционных заболеваний назначать Адалимумаб следует с осторожностью у пожилых пациентов. Среди пациентов старше 65 лет, принимавших адалимумаб, частота возникновения серьезных инфекций была выше, чем у пациентов моложе 65 лет. Возраст оказывает минимальное влияние на клиренс адалимумаба. У данной группы пациентов по сравнению с более молодыми пациентами различий в эффективности не выявлено. Корректировка дозы не требуется.
Раса, пол
У пациентов разного пола и расовой принадлежности различий показателей фармакокинетики (с поправкой на массу тела)не выявлено.
Почечная и печеночная и недостаточность
Нет сведений о фармакокинетике адалимумаба у пациентов с нарушением функции печени или почек .
Фармацевтические характеристики
Прозрачный, бесцветный или желтоватый раствор для п/к введения. В контурных ячейковых упаковках один стеклянный шприц однодозовый по 0,8 мл (в комплекте с салфеткой спиртовой).
Упаковка, срок годности, условия хранения
0.8 мл — флаконы бесцветного стекла в комплекте со шприцем с соединением Люэра в блистере, иглой инъекционной с соединением Люэра в блистере, насадкой на флакон в блистере, 2 салфетками спиртовыми. Комплект 1 или 2 упаковки упакован в пачку картонной.
Хранить в недоступном для детей, защищенном от света месте при температуре от 2° до 8°C. Не замораживать.
Срок годности — 2 года.
Наша компания работает как на территории Кыргызстана, так и осуществляет доставку в страны ближнего зарубежья. Обращайтесь к нам за консультациями по контактным телефонам.




Отзывы
Отзывов пока нет.