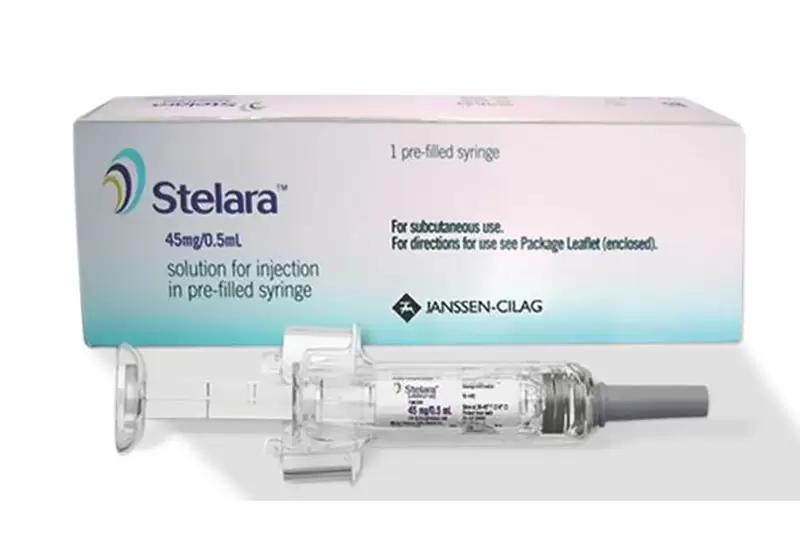
Описание
Препарата Стелара — новый препарат, для лечения активной болезни Крона умеренной или тяжелой степени при наличии противопоказаний к стандартному лечению, а также с неэффективностью или непереносимостью стандартной терапии или терапии ингибиторами ФНО. Стелара — первый биологический препарат для лечения болезни Крона, воздействующий на интерлейкины Ил-12 и Ил-23, которые считается, играют главную роль в иммунных и воспалительных реакциях организма. Основное действующее вещество препарата Стелара — Устекинумаб.
Препарат Стелара одобрен для лечения взрослых пациентов и детей от 12 до 18 лет с умеренной или тяжелой степенью бляшечного псориаза при наличии противопоказаний, при отсутствии эффекта от лечения, при непереносимости других методов системной терапии или фототерапии. Показанием к применению препарата Стелара является лечение пациентов старше 18 лет с активным псориатическим артритом. Препарат Стелара предназначен для индукции и поддержания клинической ремиссии и индукции эндоскопической ремиссии, достижения бесстероидной ремиссии, улучшения связанного со здоровьем качества жизни.
Состав Стелара
Один флакон содержит:
- действующее вещество: устекинумаб 90 мг или 135 мг
- дополнительные вещества: L-гистидин, сахароза, L-гистидина гидрохлорида моногидрат, L-метионин, полисорбат 80, динатриевая соль ЭДТА дигидрат, вода для инъекций.
Показания к применению Стелара
Для п/к введения
- Лечение у взрослых и детей от 12 до 18 лет умеренной или тяжелой степени бляшечного псориаза (при наличии противопоказаний, или при отсутствии эффекта от лечения, или при непереносимости фототерапии или других методов системной терапии).
- Взрослые: язвенный колит, болезнь Крона, активный псориатический артрит (в качестве монотерапии или в комбинации с метотрексатом).
Для в/в инфузий
Взрослые: болезнь Крона умеренной и тяжелой степени.
Фармакодинамика Стелара
Механизм действия. Устекинумаб — это полностью человеческие моноклональные антитела класса иммуноглобулинов G1k с молекулярным весом около 148600 Да. Данные антитела, продуцированы рекомбинантной клеточной линией и проходят многоступенчатую очистку: инактивацию и удаление вирусных частиц. Устекинумаб обладает высоким сродством и специфичностью к субъединице интерлейкина человека — ИЛ-12 и ИЛ-23. Препарат Стелара томозит биологическую активность ИЛ-12 и ИЛ-23, предотвращая их связывание с комплементарным рецептором ИЛ-12R-β1, экспрессируемым на поверхности иммунных клеток.
ИЛ-12 и ИЛ-23 — это гетеродимерные цитокины, секретируемые активированными антигенпрезентирующими клетками, в частности, дендритными клетками и макрофагами. ИЛ-12 и ИЛ-23 участвуют в иммунных реакциях, активируют CD4+-Т-клетки и NK-клеток (естественные киллеры). При заболеваниях, взаимосвязанных с нарушением функций иммунной системы (таких как псориаз), наблюдается нарушение регуляции ИЛ-12 и ИЛ-23. Устекинумаб ингибирует воздействие ИЛ-12 и ИЛ-23 на активацию иммунных клеток, особенно, вызываемую этими цитокинами, внутриклеточную передачу сигнала и секрецию цитокинов. Считается, что устекинумаб прерывает каскад реакций секреции цитокинов и передачи сигнала, которые играют основную роль в развитии псориаза.
Использование препарата Стелара ведет к значительному снижению гистологических проявлений псориаза, включая пролиферацию клеток эпидермиса и гиперплазию. Эти данные согласуются с клинической эффективностью. На соотношение циркулирующих в крови иммунных клеток, включая неактивированные Т-клетки и клетки памяти, а также на концентрацию цитокинов в крови, существенного влияния Устекинумаб не оказывает.
Анализ матричной РНК, выделенной из биопсийных образцов кожных очагов псориаза исходно и через 2 недели лечения, показал, что использование препарата Стелара приводит к снижению экспрессии генов, кодирующих его молекулярные мишени — ИЛ-12 и ИЛ-23, а также генов, кодирующих воспалительные цитокины и хемокины — моноцитарный хемотаксический фактор (МСР)-1, фактор некроза опухоли (TNF)-альфа, интерферон-гамма — индуцибельный белок (IP)-10 и ИЛ-8. Эти данные согласуются со значительным клиническим эффектом лечения.
Клинический эффект улучшения по шкале PASI — индекс площади и тяжести псориаза, зависит от концентрации устекинумаба в плазме крови. Среднее значение концентрации устекинумаба в плазме крови было выше у больных с лучшим результатом по шкале PASI, чем у больных с меньшим клиническим эффектом. Доля больных, у которых улучшение по шкале PASI достигало 75 процентов, увеличивалась по мере повышения концентрации устекинумаба в плазме крови.
Фармакокинетика Стелара
Всасывание.
После однократного подкожного введения в дозировке 90 мг здоровым добровольцам среднее Tmax в плазме крови составляло 8.5 суток. У больных псориазом эта величина при дозировке препарата 45 мг или 90 мг была сходна с таковой у здоровых добровольцев. Абсолютная биодоступность устекинумаба после однократного подкожного введения больным псориазом составила 57.2 процента.
Распределение.
Среднее значение объема распределения устекинумаба в терминальной фазе выведения после однократного внутривенной инфузии больным псориазом составляло 57-83 мл/кг. Согласно результатам популяционного фармакокинетического анализа объем распределения устекинумаба в равновесном состоянии составил 4.62 литров у пациентов с болезнью Крона и 4.44 литра у пациентов с язвенным колитом.
У больных с псориазом системная экспозиция устекинумаба (Сmax и AUC) повышалась пропорционально введенным дозировкам после однократного внтривенной инфузии доз в диапазоне от 0.09 мг/кг до 4.5 мг/кг, а также после однократного подкожного введения дозировок в диапазоне от 24 мг до 240 мг.
Метаболизм.
Метаболический путь устекинумаба не известен.
Выведение Стелара
После однократного внутривенного введения больным псориазом средняя величина системного клиренса устекинумаба составляла 1.99 до 2.34 мл/сут/кг.
В ходе клинических исследований период полураспада устекинумаба у пациентов с псориазом, болезнью Крона и/или псориатическим артритом находился в диапазоне от 15 до 32 дней, а его медиана составила около 3 недель.
По результатам популяционного фармакокинетического анализа клиренс устекинумаба составил 0.19 л/сут, а T1/2 — около 19 дней у пациентов с болезнью Крона и язвенным колитом.
Линейность.
У больных с псориазом системная экспозиция устекинумаба (Сmax и AUC) повышалась пропорционально введенным дозировкам после однократного внтривенной инфузии доз в диапазоне от 0.09 мг/кг до 4.5 мг/кг, а также после однократного подкожного введения дозировок в диапазоне от 24 мг до 240 мг.
С течением времени Изменение концентрации устекинумаба в плазме крови после однократных или многократных повторных применений препарата было предсказуемо в основном. При предложенном режиме терапии (вторая инъекция 4 недели спустя после первого применения, затем каждые 12 недель) к 28-й неделе в плазме крови достигалось Css устекинумаба. В среднем, Css препарата составляла 0,21–0,26 мкг/мл для дозировки 45 мг и 0,47–0,49 мкг/мл — для дозировки 90 мг. Накопления препарата Стелара на протяжении лечения длительностью 12 недель в сыворотке крови не наблюдалось.
Влияние массы тела пациента на фармакокинетику препарата.
В плазме крови от массы тела пациента зависит концентрация препарата Стелара. При введении одинаковых дозировок (45 или 90 мг) у больных с массой тела более 100 кг в плазме средняя концентрация устекинумаба была меньше, чем у больных с массой тела менее 100 кг. Однако средняя Cmin устекинумаба
Популяционный фармакокинетический анализ.
Объем распределения и кажущийся клиренс составляли 0,465 л/час в сутки и соответственно 15,7 литров. Период полувыведения препарата Стелара составлял примерно 3 недели. Возраст, пол и принадлежность к той или иной расе на кажущийся клиренс устекинумаба не влияли. масса тела пациентов влияла на кажущийся клиренс препарата, при этом величина кажущегося клиренса была больше у пациентов с большей массой тела. У пациентов с массой тела более 100 кг средний кажущийся клиренс был примерно на 55% выше такового у пациентов с меньшей массой тела. У пациентов с массой тела более 100 кг объем распределения был примерно на 37% выше такового у пациентов с меньшей массой тела.
Также на фармакокинетику препарата Стелара в ходе анализа изучали влияние имеющихся хронических заболеваний (гиперлипидемия, сахарный диабет в настоящее время или в анамнезе, артериальная гипертензия) . У пациентов с сахарным диабетом величина кажущегося клиренса была в среднем на 29% выше, чем у здоровых пациентов.
О фармакокинетике препарата Стелара у пациентов с почечной или печеночной недостаточностью данных нет.
Среди пациентов старше 65 лет популяционный фармакокинетический анализ влияния возраста на величины кажущегося клиренса и объем распределенияне выявил.
Употребление алкоголя и табака не влияло на фармакокинетику устекинумаба.
Фармацевтические характеристики
Раствор для п/к и в/в введения во флаконах. Раствор прозрачный от бесцветного до светло-желтого цвета. Раствор может содержать единичные прозрачные частицы белка.
Упаковка, срок годности, условия хранения Стелара
В шприцах и флаконах по 0,5 и 1 мл. 1 мл раствора для подкожного введения. Вместе с инструкцией упакованы в картонную коробку.
Хранить в защищенном от света месте. Хранить при температуре 2–8 °C, в оригинальной упаковке. Не замораживать. Хранить в недоступном для детей месте.
Срок годности 3 года
Не применять по истечении срока годности, указанного на упаковке.
Наша компания работает как на территории Кыргызстана, так и осуществляет доставку в страны ближнего зарубежья. Обращайтесь к нам за консультациями по контактным телефонам.
Заказать и купить Стелара (Устекинумаб) в Бишкек
Заказать и купить Стелара (Устекинумаб) в Кыргызстане
Позвоните и узнайте цену Стелара (Устекинумаб)
Работаем и отправляем Стелара (Устекинумаб) по странам СНГ: Казахстан (Алматы и Нур-Султан), Россия, Украина, Белоруссия, Узбекистан (Ташкент),
а также можем отправить Стелара (Устекинумаб) по регионам Кыргызстана: Ош, Джалал-Абад, Каракол, Узген, Балыкчы и другие.



Отзывы
Отзывов пока нет.