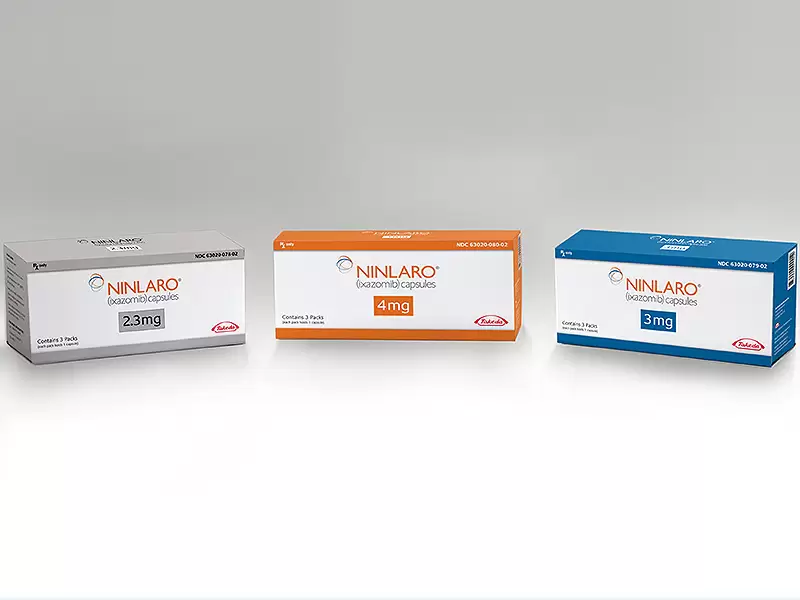
Описание
Препарат Нинларо (иксазомиб) − первый и единственный пероральный ингибитор протеасом для лечения пациентов с рецидивирующей и/или резистентной множественной миеломы, использующийся в комбинации с леналидомидом и дексаметазоном. Нинларо – выпускается в виде капсул для приема внутрь один раз в неделю.
Действующее вещество Нинларо — Иксазомиб является селективным и обратимым ингибитором протеасомы, обладающим высокой противоопухолевой активностью и прекрасным профилем безопасности.
Состав
- активное вещество: иксазомиба цитрат: 3,29/4,3/5,7 мг, что соответствует иксазомибу — 2,3/3/4 мг;
- вспомогательные вещества: МКЦ; тальк; магния стеарат;
- оболочка капсулы, дозировка 2,3 мг: желатин; титана диоксид; краситель железа оксид красный; чернила черные 10А21;
- оболочка капсулы, дозировка 3 мг: желатин; титана диоксид; краситель железа оксид черный; чернила черные 10А21;
- оболочка капсулы, дозировка 4 мг: желатин; титана диоксид; краситель железа оксид красный; краситель железа оксид желтый; чернила черные 10А21;
- чернила черные 10А2 содержат: шеллак, калия гидроксид, пропиленгликоль, краситель железа оксид черный.
Фармакодинамика
Иксазомиб является обратимым ингибитором протеасом. Иксазомиб в основном взаимодействует и подавляет химотрипсиноподобную деятельность субъединицы бета-5 20S протеасомы.
Нинларо индуцирует апоптоз у культивируемых клеточных линий множественной миеломы in vitro. In vitro нинларо демонстрировал цитотоксичность в отношении клеток миеломы, взятых у больных с развившимися рецидивами после многократных циклов терапии, включавших бортезомиб, дексаметазон и леналидомид. Комбинация нинларо и леналидомида демонстрировала синергическое цитотоксическое действие на клеточные линии множественной миеломы. В условиях in vivo нинларо демонстрировал противоопухолевое воздействие на модели опухолевого ксенотрансплантата множественной миеломы мышей.
Кардиоэлектрофизиология
Иксазомиб не удлинял интервал QTc при воздействиях, соответствующих клиническим, по результатам фармакокинетическо-фармакодинамического анализа данных 245 пациентов.
Фармакокинетика
Всасывание
После приема внутрь медиана времени достижения максимальной концентрации нинларо в плазме была равна одному часу. Значение абсолютной биодоступности после перорального приема составляло 58% по результатам популяционного анализа фармакокинетики.
Кривая AUC нинларо повышается дозозависимым способом в диапазоне доз от 0,2 до 10,6 мг. По данным исследований влияния приема пищи, проведенное у больных, получавших однократную дозу 4 мг нинларо, показало, что пища с высоким содержанием жиров понижала AUC иксазомиба на 28% и максимальную концентрацию на 69%.
Распределение
Связывание нинларо с белками плазмы составляет 99%, распределяется в эритроциты, происходит с соотношением «кровь-плазма». Объем распределения в равновесном состоянии составляет 543 литров.
Метаболизм
После перорального приема дозы с радиоизотопной меткой иксазомиб представлял 70% всего связанного с препаратом радиоактивного материала в плазме. Основным механизмом выведения препарата нинларо считают метаболизм под действием множественных ферментов CYP и не-CYP белков. Эксперименты in vitro с применением изоферментов цитохрома Р450, произведенных на основе человеческой комплементарной ДНК, показали, что при клинически значимых уровнях концентрации иксазомиба не существует специфического изофермента CYP, главным образом участвующего в метаболизме иксазомиба. При более высоких концентрациях, чем клинические, иксазомиб подвергался метаболизму под действием многих изоформ CYP.
Выведение
По результатам фармакокинетического популяционного анализа клиренс составлял около 1,9 л/час с изменчивостью индивидуальных значений величиной 44%. Период полувыведения иксазомиба в конечной фазе составлял 9,5 суток. При пероральном еженедельном использовании отношение кумуляции было определено как двукратное.
При пероральном приеме однократной дозы меченого 14С-иксазомиба у 5 больных с распространенной злокачественной опухолью 62% поступившей радиоактивности было выведено с мочой и 22% с калом. Неизменный препарат, выведенный с мочой, составлял <3.5% введенной дозы.
Особые группы пациентов
Возраст, пол, этническая принадлежность. Не наблюдалось клинически значимого влияния возраста (в диапазоне 23-91 года), расовой принадлежности, пола или площади поверхности тела (диапазон 1,2-2,7 кв.м.) на клиренс нинларо на основании фармакокинетического популяционного анализа.
Нарушения функции печени.
Фармакокинетика иксазомиба у пациентов с нормальной функцией печени была сходной с таковой у пациентов с нарушениями функции печени легкой степени (общий билирубин ≤ВГН и АСТ>ВГН, или общий билирубин >1-1.5×ВГН и любое значение АСТ) на основании популяционного анализа фармакокинетики.
Фармакокинетические данные были описаны у пациентов с нормальной функцией печени при приеме иксазомиба в дозе 4 мг (n=12), с умеренными нарушениями функции печени при дозе 2.3 мг (общий билирубин >1.5-3×ВГН, n=13) или тяжелыми нарушениями функции печени при дозе 1.5 мг (общий билирубин > 3 × ВГН, n=18). Нормализованные по дозе средние значения AUC были на 20% выше у пациентов с умеренными или тяжелыми нарушениями функции печени по сравнению с пациентами с нормальной функцией печени.
Нарушения функции почек.
Фармакокинетика иксазомиба у пациентов с нормальной функцией почек была сходной с таковой у пациентов с нарушениями функции почек легкой или умеренной степени тяжести (КК ≥ 30 мл/мин) на основании фармакокинетического популяционного анализа.
Фармакокинетические данные были описаны при дозе иксазомиба 3 мг у пациентов с нормальной функцией почек (КК ≥ 90 мл/мин, n=18), тяжелыми нарушениями функции почек (КК < 30 мл/мин, n=14) или с заболеваниями почек в терминальной стадии, требующими диализа (n=6). Средние значения AUC были на 39% выше у пациентов с тяжелыми нарушениями функции почек или с заболеваниями почек в терминальной стадии, требующими диализа, по сравнению с пациентами с нормальной функцией почек. Нинларо не выводится при проведении диализа, о чем свидетельствует, то что концентрации препарата перед диализом, во время его проведения и после проведения диализа были сходными.
Показания препарата
- в комбинации с дексаметазоном и леналидомидом применяется для лечения больных с множественной миеломой, получивших ранее как минимум одну линию терапии.
Описание лекарственной формы
- Капсулы, 2,3 мг: твердые, желатиновые, № 4. Корпус и крышечка капсулы — светло-розового цвета, имеется надпись, нанесенная черными чернилами «Takeda» — на крышечке «2.3 mg» — на корпусе.
- Капсулы, 3 мг: твердые, желатиновые, № 4. Корпус и крышечка капсулы — светло-серого цвета, имеется надпись, нанесенная черными чернилами «Takeda» — на крышечке и «3 mg» — на корпусе.
- Капсулы, 4 мг: твердые, желатиновые, № 3. Корпус и крышечка капсулы — светло-оранжевого цвета, имеется надпись, нанесенная черными чернилами «Takeda» — на крышечке и «4 mg» — на корпусе.
Фармацевтические характеристики
Содержимое капсул — порошок от белого до желтовато-белого цвета.
Упаковка, срок годности, условия хранения
По 1 капсуле в ПВХ Алюминий/Алюминий блистер. Блистер герметично вклеен в картонную обложку и неотделим от нее. По одной картонной обложке вместе с инструкцией по применению помещают в пачку картонную. Три картонные пачки помещают в общую картонную пачку. На защитной наклейке голографическим способом указывают логотип «Takeda».
Срок годности — 3 года.
Хранить при температуре не выше 30°С. Не замораживать. Хранить в оригинальной упаковке непосредственно до приема каждой капсулы. Хранить в недоступном для детей месте.
Наша компания работает как на территории Кыргызстана, так и осуществляет доставку в страны ближнего зарубежья. Обращайтесь к нам за консультациями по контактным телефонам.



Отзывы
Отзывов пока нет.